题目内容
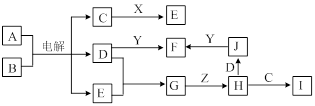
下图表示常见元素单质及化合物相应转化关系,部分反应的产物没有全部列出。

已知:B是一种黄绿色气体,C在所有气体中密度最小,D是一种碱;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料;Z为气态氧化物。
请回答下列问题:
(1)气体B具有 (填“还原性”、“氧化性”或“漂白性”),反应②属于四种基本反应类型反应中的 。
(2) 有学生认为B与X反应的产物E不一定是纯净物。他认为产物中可能还有 (填化学式),为验证其猜想该同学设计了相关实验,你认为他需要选择的试剂为 (填序号)。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.KSCN溶液 d.稀硫酸
(3)若Z能导致温室效应,则反应③的离子反应方程式为 。
(4)若Z是我国酸雨形成的罪魁祸首,目前应用最广泛的工业处理含Z废气的方法是在一定条件下与生石灰作用而使其固定,产物可作建筑材料,反应的化学方程式为 。
(5)若Z是形成酸雨的另一种主要物质,Z与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),请写出该反应的化学反应方程式 。

已知:B是一种黄绿色气体,C在所有气体中密度最小,D是一种碱;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料;Z为气态氧化物。
请回答下列问题:
(1)气体B具有 (填“还原性”、“氧化性”或“漂白性”),反应②属于四种基本反应类型反应中的 。
(2) 有学生认为B与X反应的产物E不一定是纯净物。他认为产物中可能还有 (填化学式),为验证其猜想该同学设计了相关实验,你认为他需要选择的试剂为 (填序号)。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.KSCN溶液 d.稀硫酸
(3)若Z能导致温室效应,则反应③的离子反应方程式为 。
(4)若Z是我国酸雨形成的罪魁祸首,目前应用最广泛的工业处理含Z废气的方法是在一定条件下与生石灰作用而使其固定,产物可作建筑材料,反应的化学方程式为 。
(5)若Z是形成酸雨的另一种主要物质,Z与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),请写出该反应的化学反应方程式 。
(1)氧化性 置换反应
(2)FeCl2 a
(3)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
(4)2SO2+2CaO+O2=2CaSO4(答案合理即可)
(5)NO2+2NaOH=NaNO2+NaNO3+H2O
(2)FeCl2 a
(3)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
(4)2SO2+2CaO+O2=2CaSO4(答案合理即可)
(5)NO2+2NaOH=NaNO2+NaNO3+H2O
试题分析:(1)B为黄绿色气体,可知为氯气,具有氧化性,X为铁,Y为铝,②实际是铝热反应,其类型属于置换反应。
(2)氯气与铁反应还可能的产物只能是FeCl2,验证Fe2+的存在需选择强氧化剂,如酸性高锰酸钾溶液,或者用KSCN溶液与氯水,答案选a。
(3)若Z为CO2,I溶液为NaAlO2溶液,其离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
(4)若Z为SO2,与生石灰反应先生成CaSO3后继续被氧化生成CaSO4
(5)形成酸雨的另一种物质可能为NO2,D为NaOH,二者反应生成1:1的盐,该反应的化学反应方程式为NO2+2NaOH=NaNO2+NaNO3+H2O

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 ,下列说法正确的是
,下列说法正确的是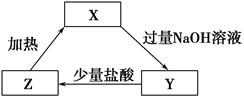
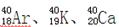 的质量数相同,所以它们互为同位素
的质量数相同,所以它们互为同位素