题目内容
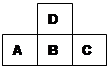
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是
A. B为第二周期的元素
B. C为VA族元素
C.三种元素都为非金属元素
D.C元素最高正价为 +7 价
| A | | C |
| | B | |
B. C为VA族元素
C.三种元素都为非金属元素
D.C元素最高正价为 +7 价
C
试题分析:设A的原子序数为x,则C的原子序数为x+2,B的原子序数为x+1+8,根据题中信息分析得:x+x+2+x+1+8=2(x+1+8),解得x=7,即A为N元素,B为S元素,C为F元素。
A项:B为第三周期的元素,故错;B项:C为VA族元素Ⅶ族元素,故错;D项:C元素,即F元素,没有最高正价,故错。故选C。
点评:本题考查的是元素周期表和元素周期律的相关知识,题目难度中,熟悉元素周期表的结构和元素周期律的内容是解题的关键。

练习册系列答案
相关题目
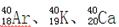 的质量数相同,所以它们互为同位素
的质量数相同,所以它们互为同位素