题目内容
3.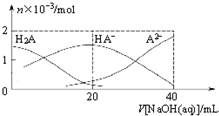 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )| A. | H2A属于强酸 | |
| B. | $\frac{c(H{A}^{-})}{c({H}_{2}{A}^{\;})}$随着V[NaOH(aq)]的增大而减小 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
分析 A.未加NaOH溶液时,溶液的pH在1-2之间,如果是强酸,溶液的pH=-lg0.2=0.7;
B.$\frac{c(H{A}^{-})}{c({H}_{2}{A}^{\;})}$随着V[NaOH(aq)]的增大先增大后减小;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.V[NaOH(aq)]=20mL时,二者恰好反应生成NaHA,根据图知,溶液中c(A2-)>c(H2A),说明HA-电离程度大于水解程度而导致溶液呈酸性.
解答 解:A.未加NaOH溶液时,如果是强酸,溶液的pH=-lg0.2=0.7,实际上溶液的pH在1-2之间,说明该酸部分电离,为弱电解质,故A错误;
B.根据图知,HA-先增大后减小,$\frac{c(H{A}^{-})}{c({H}_{2}{A}^{\;})}$随着V[NaOH(aq)]的增大先增大后减小,故B错误;
C.任何电解质溶液中都存在物料守恒,体积增大一倍,溶液中物质浓度降为原来的一半,根据物料守恒c(HA-)+c(A2-)+c(H2A)=0.05mol•L-1,故C错误;
D.V[NaOH(aq)]=20mL时,二者恰好反应生成NaHA,根据图知,溶液中c(A2-)>c(H2A),说明HA-电离程度大于水解程度而导致溶液呈酸性,但其水解和电离程度都较小,所以离子浓度大小顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,正确分析图象是解本题关键,明确各点溶液中的溶质及其性质是解本题关键,易错选项是C,注意溶液体积增大一倍时其浓度降为原来一半.

练习册系列答案
相关题目
15.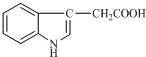 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸与苯丙氨酸互为同分异构体 | |
| B. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 | |
| C. | 1mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5mol H2 | |
| D. | 吲哚乙酸苯环上的二氯代物共有四种结构 |
20.已知铜能溶于氯化铁溶液,其反应的化学方程式为2FeCl3+Cu═2FeCl2十CuC12.现向某FeCl3溶液中加入m1 g Cu粉,完全溶解后,再加入m2 g铁粉,充分反应后得到m3 g固体.若m1>m3,则所得溶液中含有的金属阳离子是( )
| A. | Cu2+、Fe2+ | B. | Cu2+、Fe3+ | C. | Fe2+、Fe3+ | D. | Fe2+、Cl- |
15.常温下20滴水为1mL,水的密度为1g/mL,每滴水含有a个水分子,则阿伏德罗常数可表示为( )
| A. | a | B. | 2a | C. | 18a | D. | 360a |
12. 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温
度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只
投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
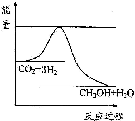
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1mol CO2 和3mol H2.
 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温
度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只
投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1mol CO2 和3mol H2.
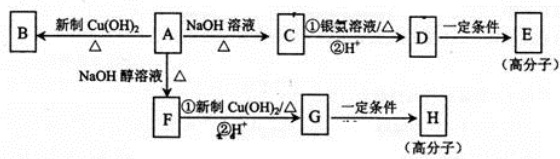
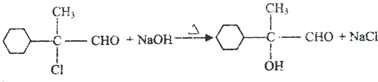 .
.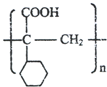 ,E的结构简式是
,E的结构简式是 .
.