题目内容
20.已知铜能溶于氯化铁溶液,其反应的化学方程式为2FeCl3+Cu═2FeCl2十CuC12.现向某FeCl3溶液中加入m1 g Cu粉,完全溶解后,再加入m2 g铁粉,充分反应后得到m3 g固体.若m1>m3,则所得溶液中含有的金属阳离子是( )| A. | Cu2+、Fe2+ | B. | Cu2+、Fe3+ | C. | Fe2+、Fe3+ | D. | Fe2+、Cl- |
分析 在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向盛有FeCl3溶液的烧杯内分别加入铁粉和铜粉,铁能与氯化铁反应生成氯化亚铁,铜能与氯化铁反应生成氯化亚铁和铜,利用此知识解决即可.
解答 解:此题中发生的化学反应有三个,方程式如下:2FeCl3+Cu=2FeCl2+CuCl2、CuCl2+Fe=FeCl2+Cu、2FeCl3+Fe=3FeCl2,
依元素守恒可知
步骤一:m1 g铜完全溶解后,变为m1 g铜离子,
步骤二:若加入的铁足够多的话,可将溶液中的铜离子全部变回金属铜(m1 g)甚至还会有铁剩余,此时,残余固体(m3g)应大于或等于m1 g,
依题意:m1>m3可知,加入的铁是不足量的,此时溶液中还有部分铜未完全置换出来,Cu与Fe3+是不能共存的,剩余固体中有Cu,则溶液中必无Fe3+,所以金属阳离子是Cu2+、Fe2+,故选:A.
点评 本题考查了金属活动性顺序的应用,难度不大,完成此题,可以依据金属活动性顺序及其意义进行,要注意根据铁和铜的活动性强弱确定反应的先后顺序.

练习册系列答案
相关题目
10. 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大.
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大.
15.已知:硫酸溶液的浓度越大,密度越大.现将50g溶质质量分数为w1,物质的最浓度c1的硫酸沿玻璃棒加入到Vm1水(设水的密度为1g/ml)中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
| A. | 若c1=2c2,则w1<2w2,V<50mL | B. | 若c1=2c2,则w1<2w2,V=50mL | ||
| C. | 若w1=2w2,则c1<2c2,V>50mL | D. | 若w1=2w2,则c1>2c2,V<50mL |
3.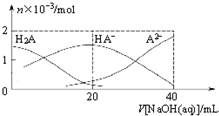 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )| A. | H2A属于强酸 | |
| B. | $\frac{c(H{A}^{-})}{c({H}_{2}{A}^{\;})}$随着V[NaOH(aq)]的增大而减小 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
10.下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 0.2 mol/L CH3COONa溶液和0.1 mol/L HCl溶液等体积混合后:c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl-) | |
| C. | 0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 物质的量浓度相等的HCN(弱酸)和NaCN溶液等体积混合后有:c(HCN)+2c(H+)═2c(OH-)+c(CN-) |