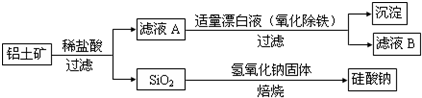
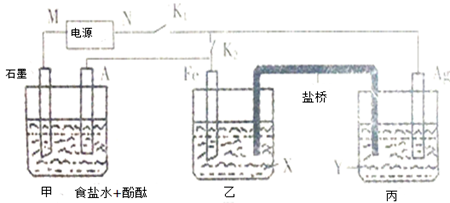
题目内容
13.将4.48L Cl2(标准状况)通入足量的NaOH溶液中,充分反应后生成NaClO物质的量是多少?分析 发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,根据n=$\frac{V}{{V}_{m}}$计算氯气物质的量,再根据方程式计算生成NaClO物质的量.
解答 解:标况下4.48L Cl2的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,
设生成NaClO物质的量为x,则:
Cl2+2NaOH=NaCl+NaClO+H2O
1 1
0.2mol x
所以x=$\frac{0.2mol×1}{1}$=0.2mol
答:充分反应后生成NaClO物质的量是0.2mol.
点评 本题考查化学方程式的计算,明确发生的反应即可解答,注意对化学方程式意义的理解,比较基础.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
4.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在0℃、101 kPa时,22.4L氢气中含有NA个氢原子 | |
| B. | NA个CO分子和0.5mol CH4的质量比为7:4 | |
| C. | 16gCH4与18gNH${\;}_{4}^{+}$所含质子数相等 | |
| D. | 常温常压下,92g的NO2和N2O4混合气体中含有的原子数为6NA |
18.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 标准状况下,11.2L苯中含有的碳碳双键数目为1.5NA | |
| B. | 常温常压下,2.8g由N2和CO组成的混合气体中含有的原子数为0.1NA | |
| C. | 25℃时,1.0LpH=12的Na2CO3溶液中含有的阴离子数大于0.01NA | |
| D. | 在反应:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,生成1molCu,转移的电子数为2NA |
3.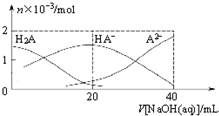 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )| A. | H2A属于强酸 | |
| B. | $\frac{c(H{A}^{-})}{c({H}_{2}{A}^{\;})}$随着V[NaOH(aq)]的增大而减小 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
20.“化学是一门中心学科,与社会发展的需要有密切的关系”.下列有关叙述不正确的是( )
| A. | 为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( ) | |
| B. | 积极推行和使用能被微生物降解的新型聚合物材料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 废旧电池应集中回收,不能填埋处理 |