题目内容
12. 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温
度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只
投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
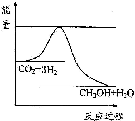
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1mol CO2 和3mol H2.
分析 (1)①△G=△H-T△S<0时,反应自发进行;
②反应达到平衡状态时,同种物质的正、逆反应速率相等,平衡时各组分的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③平衡常数是生成的浓度比反应物浓度幂之积,平衡常数的表达式K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;
(2)反应H2O(g)+CO(g)?H(g)+CO2(g)中,反应物和生成物的体积相等,压强对平衡移动无影响,从等效平衡的角度结合浓度对平衡的影响分析;
(3)根据图象知,该反应的正反应是放热反应,能使c(CH3OH)减小,说明平衡向逆反应方向移动.
解答 解:(1)①在高温下能自发进行,根据△G=△H-T△S<0,而该反应中△H>0,所以△S>0,故答案为:△S>0;
(2)A.在一个容积可变的密闭容器,容器中的压强始终不变,故错误;
B.1mol H-H 键断裂等效于生成2mol H-O 键同时断裂2mol H-O 键,正逆反应速率相等,故正确;
C.V (CO)=V (H2)只要反应发生就符合V (CO)=V (H2),故错误;
D.密闭容器的容积不再改变,说明气体的物质的量不变,达平衡状态,故正确;
E.消耗1mol 水的同时生成1mol H2,都反应的是正反应方向,故错误;
F.容器的密度不变,说明气体的摩尔质量不变,反应达平衡状态,故正确;
故选:BDF;
③平衡常数是生成的浓度比反应物浓度幂之积,平衡常数的表达式K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$,故答案为:$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;
(2)A.丙中浓度最大,甲中浓度最小,浓度越大,反应速率越大,则反应开始时,丙中的反应速率最快,甲中的反应最慢,故A正确;
B. 以甲计算:
H2O(g)+CO(g)?H2(g)+CO2(g)
起始:0 0 0.010 0.010
转化:x x x x
平衡:x x 0.01-x 0.01-x
则$\frac{(0.01-x)×(0.01-x)}{{x}^{2}}$=$\frac{4}{9}$,
x=0.006,则平衡时甲中的H2的转化率均是$\frac{0.006}{0.01}$=60%,由于甲和丙的气体的比值相同,为等效平衡状态,则丙中H2的转化率也为60%,故B错误;
C.由B计算可知,平衡时,丙中的c(CO2)是甲中的2倍,应为2×(0.01-0.006)mol/L=0.008mol/L,故C正确;
D.乙与甲相比较,相当于在甲的基础上通入H2,则平衡向逆反应方向移动,平衡时,乙中的CO2的转化率大于60%,故D正确.
故答案为:B;
(3)A.升高温度,平衡逆向移动,能使c(CH3OH)减小,故正确;
B.充入He(g),使体系压强增大,但各组分的浓度不变,平衡不移动,故错误;
C.将H2O(g)从体系中分离出来,平衡正向移动,故错误;
D.再充入1mol CO2 和3mol H2,两边的气体计量数相等,所以平衡时各组分的物质的量是原来的2倍,所以浓度不变,故错误;
故选:A.
点评 本题考查学生影响化学反应速率的因素和影响化学平衡移动的因素,可以根据所学知识进行回答,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在0℃、101 kPa时,22.4L氢气中含有NA个氢原子 | |
| B. | NA个CO分子和0.5mol CH4的质量比为7:4 | |
| C. | 16gCH4与18gNH${\;}_{4}^{+}$所含质子数相等 | |
| D. | 常温常压下,92g的NO2和N2O4混合气体中含有的原子数为6NA |
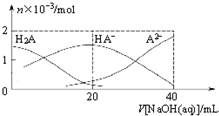 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )| A. | H2A属于强酸 | |
| B. | $\frac{c(H{A}^{-})}{c({H}_{2}{A}^{\;})}$随着V[NaOH(aq)]的增大而减小 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| A. | 为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( ) | |
| B. | 积极推行和使用能被微生物降解的新型聚合物材料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 废旧电池应集中回收,不能填埋处理 |
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
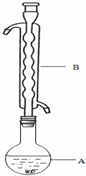
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是冷凝管或冷凝器.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物的接触面积,加快反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4,反之不含.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
| A. | 磷酸晶体和磷酸溶液 | B. | 硝酸钾晶体和熔化的硝酸钾 | ||
| C. | 蔗糖晶体和熔化的蔗糖 | D. | 熟石灰和澄清石灰水 |
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-368.15 kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-736.3 kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H═-675.3 kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H═-1 472.6 kJ•mol-1 |