题目内容
15.常温下20滴水为1mL,水的密度为1g/mL,每滴水含有a个水分子,则阿伏德罗常数可表示为( )| A. | a | B. | 2a | C. | 18a | D. | 360a |
分析 根据m=ρV计算水的质量,根据n=$\frac{m}{M}$计算水的物质的量,结合N=nNA计算.
解答 解:水的质量为1mL×1g/mL=1g,其物质的量为$\frac{1g}{18g/mol}$=$\frac{1}{18}$mol,则20d=$\frac{1}{18}$mol×NA,故NA=360d mol-1,故选D.
点评 本题考查物质的量计算、阿伏伽德罗常数,侧重考查学对公式的理解与应用,难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
7.下列混合物可采用蒸馏法分离的一组是( )
| A. | 水与四氯化碳 | B. | 食盐与泥沙 | C. | 硝酸钾与氯化钾 | D. | 溴与四氯化碳 |
3.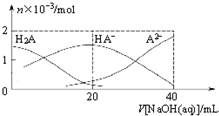 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )| A. | H2A属于强酸 | |
| B. | $\frac{c(H{A}^{-})}{c({H}_{2}{A}^{\;})}$随着V[NaOH(aq)]的增大而减小 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
10.下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 0.2 mol/L CH3COONa溶液和0.1 mol/L HCl溶液等体积混合后:c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl-) | |
| C. | 0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 物质的量浓度相等的HCN(弱酸)和NaCN溶液等体积混合后有:c(HCN)+2c(H+)═2c(OH-)+c(CN-) |
20.“化学是一门中心学科,与社会发展的需要有密切的关系”.下列有关叙述不正确的是( )
| A. | 为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( ) | |
| B. | 积极推行和使用能被微生物降解的新型聚合物材料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 废旧电池应集中回收,不能填埋处理 |
4.下列各组物质中,各成分都属于电解质的是( )
| A. | 磷酸晶体和磷酸溶液 | B. | 硝酸钾晶体和熔化的硝酸钾 | ||
| C. | 蔗糖晶体和熔化的蔗糖 | D. | 熟石灰和澄清石灰水 |
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:K+、Na+、Cu2+、SO42- | |
| B. | c(OH-)=10-13 mol•L-1的溶液中:Al3+、NO3-、I-、Cl- | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、Cl-、NO3-、SO42- | |
| D. | 0.1 mol•L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- |