题目内容
7.若标况下,1体积水溶解700体积的氨气所得溶液密度为0.9g/cm3.这种氨水的物质的量浓度和溶质的质量分数分别为( )| A. | 18.4mol/L 34.7% | B. | 20.4mol/L 38.5% | ||
| C. | 18.4mol/L 38.5% | D. | 20.4mol/L 34.7% |
分析 NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质,设水的体积为1L,则氨气的体积为700L,根据n=$\frac{m}{M}$计算氨气的物质的量,再根据m=nM计算氨气质量,溶液质量=氨气质量+水的质量,进而计算溶液质量分数,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质,
设水的体积为1L,氨气的体积为700L,则氨气的物质的量为$\frac{700L}{22.4L/mol}$=31.25mol,
溶液的质量为1000g+31.25mol×17g/mol=1531.25g,
溶液的体积为$\frac{1531.25g}{900g/L}$=1.7L,
则氨水的质量分数为w=$\frac{31.25mol×17g/mol}{1531.25g}$×100%=34.7%,
氨水的物质的量浓度为c=$\frac{31.25mol}{1.7L}$=18.4 mol/L,
故选A.
点评 本题考查物质的量浓度和质量分数的计算,难度中等,溶液的体积计算是解答本题的关键也是易错点.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
15.下列物质不可能由一种元素组成的是( )
| A. | 单质 | B. | 氧化物 | C. | 混合物 | D. | 纯净物 |
12. 常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )
常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )
 常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )
常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )| A. | HA为一元强酸,NOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | K点所示溶液中c(A-)>c(M+) | |
| D. | K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
19.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( ) 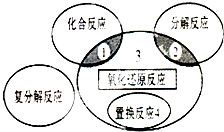

| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | D. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ |
16.NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1.0L 1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA |
17.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D单质在C单质中燃烧时剧烈放热并发出耀眼的白光,A、B形成的气态化合物的水溶液呈碱性.下列说法错误的是( )
| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4<A2C | |
| C. | B元素的最高价氧化物的水化物与D单质反应不能生成A2气体 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |

 ;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用饱和食盐水来代替水.
;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用饱和食盐水来代替水.