题目内容
18.某强酸性溶液X中可能含有H+、A13+、NH4+、Fe2+、CO32-、SO42-、C1-、NO3-中的若干种.某研究性小组为了探究其成分,进行了如下实验:
请回答下列问题:
(1)沉淀C的化学式为BaSO4,气体A的化学式为NO.
(2)写出向溶液H中通入过量CO2气体生成沉淀I的离子方程式:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-.
(3)通常可以利用KClO在KOH溶液中氧化沉淀G来制备一种新型、高效、多功能水处理剂K2MO4.(M为G中的一种元素,K2MO4易溶于水)请写出制备过程中的离子方程式(M用具体的元素符号表示)3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O.
(4)无法确定的离子是C1-,请设计实验验证该离子是否存在的方法取少量的B溶液于试管中,(滴加稀硝酸酸化),滴加AgNO3溶液,若有白色沉淀生成,证明含有C1-;若无白色沉淀生成,证明不含C1-.
分析 强酸性溶液中存在H+,不会存在CO32-,且Fe2+、NO3-不能同时存在;加入X的溶液中加入硝酸钡溶液后产生气体A、溶液B和沉淀C,沉淀只能为硫酸钡,原溶液中一定存在SO42-,气体A为NO,原溶液中一定存在Fe2+,则一定不存在NO3-;向溶液B中加入过量氢氧化钠溶液产生气体F、沉淀G和溶液H,F只能为氨气,原溶液中一定存在NH4+,沉淀G为氢氧化铁;向溶液H中通入过量二氧化碳气体产生沉淀I和溶液J,沉淀I为氢氧化铝沉淀,则溶液H中含有偏铝酸根离子,故原溶液中一定存在A13+;根据分析可知,不能确定是否含有氯离子,据此进行解答.
解答 解:强酸性溶液中存在H+,不会存在CO32-,且Fe2+、NO3-不能同时存在;加入X的溶液中加入硝酸钡溶液后产生气体A、溶液B和沉淀C,沉淀只能为硫酸钡,原溶液中一定存在SO42-,气体A为NO,原溶液中一定存在Fe2+,则一定不存在NO3-;向溶液B中加入过量氢氧化钠溶液产生气体F、沉淀G和溶液H,F只能为氨气,原溶液中一定存在NH4+,沉淀G为氢氧化铁;向溶液H中通入过量二氧化碳气体产生沉淀I和溶液J,沉淀I为氢氧化铝沉淀,则溶液H中含有偏铝酸根离子,故原溶液中一定存在A13+;根据分析可知,不能确定是否含有C1-,
(1)结合分析可知,沉淀C为BaSO4,气体A为一氧化氮,其化学式为NO,
故答案为:BaSO4;NO;
(2)溶液H中含有偏铝酸根离子,偏铝酸根离子与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-,
故答案为:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-;
(3)沉淀G为氢氧化铁,通常可以利用KClO在KOH溶液中氧化Fe(OH)3来制备一种新型、高效、多功能水处理剂K2MO4,则K2MO4为K2FeO4,反应的离子方程式为:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O;
(4)根据分析可知,无法确定的离子为C1-,通常用稀硝酸酸化的硝酸银溶液检验,所以验证方法为:取少量的B溶液于试管中,(滴加稀硝酸酸化),滴加AgNO3溶液,若有白色沉淀生成,证明含有C1-;若无白色沉淀生成,证明不含C1-,
故答案为:C1-;取少量的B溶液于试管中,(滴加稀硝酸酸化),滴加AgNO3溶液,若有白色沉淀生成,证明含有C1-;若无白色沉淀生成,证明不含C1-.
点评 本题考查了常见离子的性质及推断,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题侧重考查学生的分析能力及逻辑推理能力.

| A. | 新制Cu(OH)2浊液可鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液 | |
| B. | 用无水乙醇、冰醋酸、3mol/L硫酸制乙酸乙酯 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 可用分液漏斗分离甘油和水 |
| A. | 水和酒精 | B. | 水和苯 | C. | 苯和溴苯 | D. | 水和醋酸 |
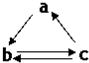 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
| A. | 18.4mol/L 34.7% | B. | 20.4mol/L 38.5% | ||
| C. | 18.4mol/L 38.5% | D. | 20.4mol/L 34.7% |

