题目内容
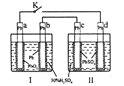
【题目】某化学兴趣小组利用反应:Cu+2Fe3+=Cu2++2Fe2+设计的原电池实验装置如图。请回答下列问题:
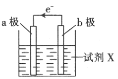
(1)b极发生___(填“氧化”或“还原”)反应,其电极材料为___,b电极反应式为:____。
(2)a极为____(填“正极”或“负极”),其电极材料可能为___,a极的电极反应式为____。
(3)该电池放电过程中,若测得电解质溶液的质量与时间的关系如图所示,则反应从开始至t1时,电路中转移电子的物质的量为_______mol。

【答案】氧化 铜 Cu - 2e- = Cu2+ 正极 银 Fe3++e-=Fe2+ 0.4
【解析】
根据氧化还原反应Cu+2Fe3+=Cu2++2Fe2+设计原电池,电池工作时,负极发生氧化反应,正极发生还原反应,电流从电池正极流出,电子从电池负极流出,该反应中Cu发生氧化反应,所以Cu作负极,正极材料应该是活动性比Cu更弱,可以用银或石墨作正极,可溶性的铁盐溶液为电解质溶液,,据此分析解答。
(1)由图可知,电子从b极流出,b为原电池的负极,由分析可知,负极材料为铜,失去电子发生氧化反应,电极反应式为:Cu - 2e- = Cu2+,答案为:氧化;铜;Cu - 2e- = Cu2+;
(2)由图知电子从b极流出,经导线流入a极,故a极为原电池的正极,负极材料为铜,正极材料应该是活动性比Cu更弱,金属活动性Cu后面的银或石墨都可作正极,试剂X为可溶性的铁盐溶液,溶液里的阳离子Fe3+在正极得到电子发生还原反应,电极反应式为:Fe3++e-=Fe2+,答案为:正极;银;Fe3++e-=Fe2+;
(3)由图像可知反应从开始至t1时,电解质溶液质量增加了12.8g,即有12.8gCu发生反应变成离子进入溶液,设转移的电子的物质的量为x,根据Cu电极的电极反应式计算:
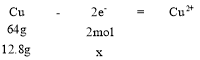 列比例式为
列比例式为![]() ,解得x=0.4mol。
,解得x=0.4mol。