题目内容
【题目】氮是地球上含量比较丰富的一种元素,氮的化合物在工业生产和生活中有重要的作用。
I.已知298K时,发生反应:N2O4(g) ![]() 2NO2(g)
2NO2(g)
(1)反应达到平衡后,压缩容器的体积,再次达到平衡时混合气体的颜色 ____(填“变深”、“变浅”或“不变”)。
(2)恒容密闭容器中发生上述反应,已知v正=k正·p(N2O4),v逆=k逆·p2(NO2),Kp=___________(用k正、k逆表示)。若初始压强为100kPa,k正=2.8×104s-1,当NO2的体积分数为40%时,v正=__________kPa·s-1。[其中p(N2O4)和p(NO2)分别是N2O4和NO2的分压,分压=p总×气体体积分数,k正、k逆为速率常数]
Ⅱ.在催化剂作用下,H2可以还原NO消除污染,反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=akJ·mol-1
N2(g)+2H2O(g) △H=akJ·mol-1
(3)若每生成7g N2放出166kJ的热量,则a=____。
(4)该反应分两步进行:
①2NO(g)+H2(g)![]() N2(g)+H2O2(g) △H1
N2(g)+H2O2(g) △H1
②H2O2(g)+H2(g)![]() 2H2O(g) △H2
2H2O(g) △H2
已知:i.总反应分多步进行时,较慢的一步决定总反应速率;
III.总反应的速率表达式v=kc2(NO)·c(H2)(k为速率常数,只和温度有关)。由上述信息可知,正反应的活化能较低的是____(填“①”或“②”)。
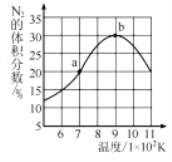
(5)将2molNO和1molH2充入一个恒容的密闭容器中,经相同时间测得N2的体积分数与温度的关系如图所示。低于900K时,N2的体积分数_____(填“是”或“不是”)对应温度下平衡时的体积分数,原因是_____。高于900K时,N2的体积分数降低的可能原因是____。
【答案】变深 ![]() 2.1×106 -664 ② 不是 该反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低 催化剂的活性下降、升温平衡逆向移动、副反应增多等
2.1×106 -664 ② 不是 该反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低 催化剂的活性下降、升温平衡逆向移动、副反应增多等
【解析】
(1)反应![]() 达到平衡后,压缩容器的体积,二氧化氮的浓度变大而使混合气体的颜色变深,虽然平衡会逆向移动,但是,根据平衡移动原理可知,再次达到平衡时混合气体的颜色仍比原平衡深,故答案为:变深;
达到平衡后,压缩容器的体积,二氧化氮的浓度变大而使混合气体的颜色变深,虽然平衡会逆向移动,但是,根据平衡移动原理可知,再次达到平衡时混合气体的颜色仍比原平衡深,故答案为:变深;
(2)反应达到平衡状态,v正=v逆,即k正·p(N2O4)=k逆·p2(NO2),将其变式可得 ,设起始时N2O4的物质的量为1mol,列三段式有:
,设起始时N2O4的物质的量为1mol,列三段式有:
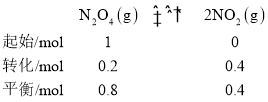
则![]()
v正=k正·p(N2O4)= 2.8×104s-1×75kPa=2.1×106kPa·s-1,故答案为:![]() ;2.1×106;
;2.1×106;
(3)由生成7g(0.25mol)N2放出166kJ的热量,可知,生成1molN2放出166×4=664kJ的热量,则a=-664,故答案为:-664;
(4)由总反应的速率表达式v=kc2(NO)·c(H2)可知,NO只出现在第①步反应,故第①步反应决定总反应速率,则①为慢反应,其正反应的活化能较高,则反应②的活化能较低,故答案为:②;
(5)由(3)可知,反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g),正反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低。由图像可知,N2的最大体积分数对应的温度为900K,当低于900K时, N2的体积分数随着温度的升高而增大,所以在此温度范围内N2的体积分数不是对应温度下平衡时的体积分数。当温度高于900K时,催化剂的活性下降、升温平衡逆向移动,或者副反应增多,从而使得N2的体积分数降低,故答案为:不是;该反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低;催化剂的活性下降、升温平衡逆向移动、副反应增多等。
N2(g)+2H2O(g),正反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低。由图像可知,N2的最大体积分数对应的温度为900K,当低于900K时, N2的体积分数随着温度的升高而增大,所以在此温度范围内N2的体积分数不是对应温度下平衡时的体积分数。当温度高于900K时,催化剂的活性下降、升温平衡逆向移动,或者副反应增多,从而使得N2的体积分数降低,故答案为:不是;该反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低;催化剂的活性下降、升温平衡逆向移动、副反应增多等。