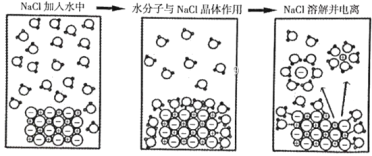
题目内容
【题目】碘酸钾(![]() )是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中
)是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中![]() 的纯度:
的纯度:
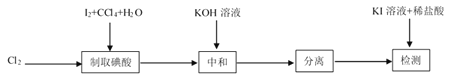
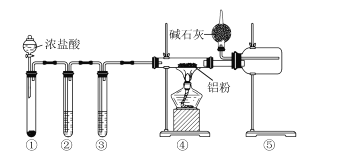
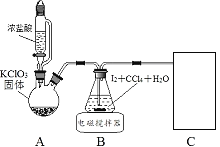
其中制取碘酸(![]() )的实验装置见图,有关物质的性质列于表中
)的实验装置见图,有关物质的性质列于表中
物质 | 性质 |
HIO3 | 白色固体,能溶于水,难溶于CCl4 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生氧化反应:ClO-+IO3-=IO4-+Cl- |
回答下列问题
(1)装置A中参加反应的盐酸所表现的化学性质为______________。
(2)装置B中反应的化学方程式为___________________ 。B中所加CCl4的作用是_________从而加快反应速率。
(3)分离出B中制得的![]() 水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低
水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低![]() 的产率。
的产率。
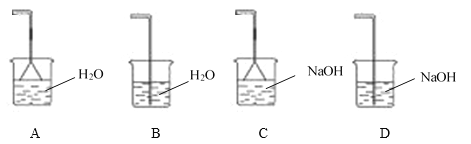
(4)为充分吸收尾气,保护环境,C处应选用最合适的实验装置是____________(填序号)。
(5)为促使![]() 晶体析出,应往中和所得的
晶体析出,应往中和所得的![]() 溶液中加入适量的___________。
溶液中加入适量的___________。
(6)取1.000g![]() 产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L
产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L![]() 溶液滴定。滴定至终点时蓝色消失(
溶液滴定。滴定至终点时蓝色消失(![]() ),测得每次平均消耗
),测得每次平均消耗![]() 溶液25.00mL。则产品中
溶液25.00mL。则产品中![]() 的质量分数为___(结果保留三位有效数字)。
的质量分数为___(结果保留三位有效数字)。
【答案】还原性、酸性 ![]() 充分溶解
充分溶解![]() 和
和![]() ,以增大反应物浓度 分液 除去
,以增大反应物浓度 分液 除去![]() (或
(或![]() ),防止氧化
),防止氧化![]() C 乙醇(或酒精) 89.5%。
C 乙醇(或酒精) 89.5%。
【解析】
装置A用于制取Cl2,发生的反应为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,装置B中发生的是制取HIO3的反应,装置C为尾气处理装置,既要吸收尾气中的HCl和Cl2,还要防止倒吸。
(1)装置A中发生的反应为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,浓盐酸中的Cl元素有一部分失电子转化为Cl2,表现出还原性,还有一部分Cl元素没有变价转化为KCl(盐),表现出酸性,故答案为:还原性、酸性;
(2)装置B中发生的反应为:5Cl2+I2+6H2O=2HIO3+10HCl,Cl2和I2均难溶于水,易溶于CCl4,加入CCl4可使二者溶解在CCl4中,增大反应物浓度,故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;充分溶解I2和Cl2,以增大反应物浓度;
(3)分离B中制得的HIO3水溶液的操作为分液,HIO3溶液中混有的Cl2在碱性条件下转化为ClO-,ClO-会将IO3-氧化为IO4-,因此在中和前需要将Cl2除去,故答案为:分液;除去Cl2(或ClO-),防止氧化KIO3;
(4)尾气中主要含HCl和Cl2,需用NaOH溶液吸收,同时要防止倒吸,故答案为:C;
(5)因为KIO3难溶于乙醇,向KIO3溶液中加入乙醇可降低其溶解度,促使KIO3晶体析出,故答案为:乙醇(或酒精);
(6)每20mLKIO3溶液中,加入KI溶液和稀盐酸发生的反应为:IO3-+5I-+6H+=3I2+3H2O,滴定时发生的反应为:I2+2S2O32-=2I-+S4O62-,可列出关系式:IO3-~3I2~6S2O32-,每次平均消耗的n(S2O32-)= 0.1004mol/L×0.025L=0.00251mol,则每20mLKIO3溶液中,n(KIO3)=n(IO3-)= n(S2O32-)÷6=0.00251mol÷6=0.000418mol,200mL溶液中,n(KIO3)=0.00418mol,产品中KIO3的质量分数=![]() =89.5%,故答案为:89.5%。
=89.5%,故答案为:89.5%。

【题目】用“吸收—电解”循环法脱除烟气中的SO2,可减少对大气的污染。室温下,电解液K再生的装置如图所示,其中电解液的pH随![]() 变化的关系见下表,下列对此判断正确的是
变化的关系见下表,下列对此判断正确的是
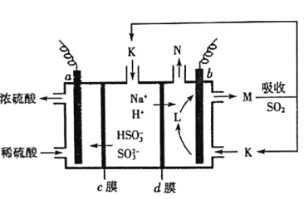
电解液 | n(SO32-):n(HSO3-) | pH |
K | 9:91 | 6.2 |
L | 1:1 | 7.2 |
M | 91:9 | 8.2 |
A.当电解液呈中性时溶液中:![]()
B.再生液M吸收SO2主反应的离子方程式为:![]()
C.HSO3-在b极发生的电极反应式为:![]()
D.若产生标准状况下2.24L气体N,则d膜上共通过0.2mol阳离子