题目内容
【题目】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为_______。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为_______。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属_______分子(选填“极性”“非极性”),其立体构型为____。
(3)橙红色晶体羰基钴Co2(CO)8的硬度小,不导电,可溶于多数有机溶剂。该晶体属于____晶体,三种元素电负性由大到小的顺序为(填元素符号)_______。配体CO中σ键与π键数之比是__________。
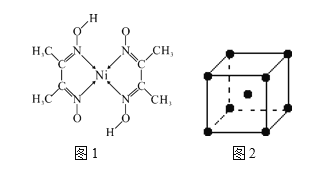
(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图1所示,分子内的作用力不可能含有__________(填序号)。
A 离子键 B 共价键 C 金属键 D 配位键 E 氢键
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图2所示,已知钨的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则每个钨原子的半径r=_____________nm。(只需列出计算式)
【答案】1s22s22p63s23p63d74s2(或[Ar]3d74s2) sp2 极性 平面三角形 分子 O>C>Co 1:2 AC ![]() ×107
×107
【解析】
(1)钴是27号元素,核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2;石墨烯中的每个碳原子形成一个C、C双键和2个C、C单键;
(2)甲醛分子的结构简式为![]() ,分子中含有醛基;
,分子中含有醛基;
(3)羰基钴熔点低,可溶于多数有机溶剂,所以属于分子晶体;金属性越强,电负性越小,非金属性越强,电负性越大;配体CO与氮气为等电子体;
(4)由图可知,该化合物分子中存在C、C共价键、N→Ni配位键、H—O键的H原子与邻近N—O键的O原子间形成的氢键;
(5)由均摊法计算可得。
(1)钴是27号元素,核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2;石墨烯中的每个碳原子形成一个C=C双键和2个C-C单键,所以石墨烯中碳原子杂化方式为sp2,故答案为:1s22s22p63s23p63d74s2(或[Ar]3d74s2);sp2;
(2)甲醛分子的结构简式为![]() ,分子中含有醛基,C原子采用sp2杂化,分子呈平面三角形,键角1200,因为结构不对称,是一种极性分子,故答案为:极性;平面三角形;
,分子中含有醛基,C原子采用sp2杂化,分子呈平面三角形,键角1200,因为结构不对称,是一种极性分子,故答案为:极性;平面三角形;
(3)由题意可知,羰基钴熔点低,可溶于多数有机溶剂,所以属于分子晶体;金属性越强,电负性越小,非金属性越强,电负性越大,Co为金属元素,非金属性O元素大于C元素,则电负性O>C>Co;配体CO与氮气为等电子体,结构相似,分子中含有1个σ键和2个π键,σ键与π键的个数比为1:2,故答案为:分子; O>C>Co;1:2;
(4)由图可知,该化合物分子中存在C、C共价键、N→Ni配位键、H—O键的H原子与邻近N—O键的O原子间形成的氢键,不含有离子键和金属键,故答案为:AC;
(5)由晶胞示意图可知,晶胞中含有8×![]() +1=2个钨原子,总质量为
+1=2个钨原子,总质量为![]() ,设每个钨原子的半径为rcm,钨晶体晶胞属于体心立方,立方体对角线长4rcm,因此晶胞边长为
,设每个钨原子的半径为rcm,钨晶体晶胞属于体心立方,立方体对角线长4rcm,因此晶胞边长为![]() ,则由(
,则由(![]() )3ρ=
)3ρ=![]() 可得r=
可得r=![]() cm=
cm=![]() ×107nm,故答案为:
×107nm,故答案为:![]() ×107。
×107。

【题目】化学反应条件是研究化学反应的重要方向。
(1)化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g)+H2(g) △H=+139kJ·mol-1
C4H8(g)+H2(g) △H=+139kJ·mol-1
一定条件下,以异丁烷为原料生产异丁烯,在202kPa和808kPa下异丁烷平衡转化率随温度的变化如图所示。
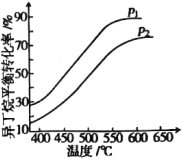
①p1=_______kPa,选择异丁烯制备的温度条件是550~600℃的理由是_________________。
②若平衡混合气中异丁烯的体积分数为25%,则异丁烷的平衡转化率为_______%(保留小数点后1位)。
(2)异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-0为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以r-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26. 17 | 27. 11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a 载体会影响催化剂的活性 b 载体会影响催化剂的选择性 c 载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:__________。
(3)工业上用复合氧化钴(组成为Co3O4)、碳酸锂以Li/Co(原子比)=1混合,在空气中900℃下加热5小时制备锂离子电池正极材料LiCo O2,写出制备LiCoO2的化学方程式__________。废旧的锂离子电池需要回收,“放电处理”废旧的锂离子电池有利于锂在正极回收的原因是____________。
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D