题目内容
【题目】无水氯化锰![]() 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入![]() 溶液,充分反应后加入
溶液,充分反应后加入![]() 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入![]() 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
|
|
| |
初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤I中:
①Fe2+浓度降,滤渣中存在![]() 。结合离子方程式解释原因:_______。
。结合离子方程式解释原因:_______。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______。
(3)步骤II中:
①![]() 酸性溶液的作用:_______。
酸性溶液的作用:_______。
②结合离子方程式说明MnCO3的作用: _______。
(4)步骤III通入H2S后, Ni2+不达标而![]() 达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
(5)测定无水![]() 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量![]() ,使
,使![]() 氧化为
氧化为![]() 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵![]() 滴定
滴定![]() ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①样品中MnCl2的质量分数是_____(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的![]() 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
【答案】Mn + 2HCl = MnCl2 + H2↑ 空气中的O2 将部分Fe2+氧化为Fe(OH)3沉淀,相关的离子方程式为:4Fe2+ + O2 + 10H2O = 4Fe(OH)3↓+ 8H+ Pb2+ + Mn = Pb + Mn2+ 将剩余Fe2+氧化为Fe3+,调节pH使Fe3+转化为Fe(OH)3沉淀除去 MnCO3+2H+=Mn2++H2O+CO2↑,Fe3++3H2O![]() Fe(OH)3+3H+ <
Fe(OH)3+3H+ < ![]() 偏高
偏高
【解析】
制备无水氯化锰的原料是含有Fe,Ni,Pb等金属杂质的粗锰粉,因此制备过程中要将Fe,Ni,Pb等杂质元素去除;第一步将粗锰粉加酸溶解,Fe溶解后产生Fe2+,由于其还原性较强,容易被氧气氧化;由于金属活动性Mn>Fe>Ni>Pb,所以溶液中Pb2+会与未反应完全的Mn反应,造成Pb2+浓度下降;第二步加入过氧化氢,主要是为了将Fe2+氧化为Fe3+,便于沉淀法去除;第三步通入H2S,是想通过生成硫化物沉淀的方式去除残余的Zn2+和Pb2+,由于Pb的去除达标,而Zn的仍未达标,所以PbS的溶解度应该更低。
(1)Mn与盐酸反应的化学方程式为:![]() ;
;
(2)①将粗锰粉酸浸后,Fe单质转化为还原性较强的Fe2+,静置一段时间,Fe2+会被空气中的氧气氧化,进而生成Fe(OH)3沉淀,相应的离子方程式为:![]() ;
;
②由于金属活动性Mn>Fe>Ni>Pb,所以溶液中Pb2+会与未反应完全的Mn反应,造成Pb2+浓度下降,因此与之相关的反应为:![]() ;
;
(3)①通过分析可知,过氧化氢的作用是将溶液中的Fe2+氧化为Fe3+,便于调节pH值将其转化为Fe(OH)3沉淀除去;
②通过分析可知,MnCO3的作用即调节溶液的pH值以便于Fe3+沉淀,相关的离子方程式为:![]() 以及
以及![]() ;
;
(4)通过分析可知,PbS的溶解度更小;
(5)①由题可知,ag无水氯化锰中的Mn2+经过氧化后全部转变为Mn3+,硫酸亚铁铵与Mn3+反应时,Mn3+和Fe2+按照1:1反应,所以MnCl2的质量分数为: ;
;
②若不加热,溶液中剩余的硝酸铵会在酸性条件下体现氧化性能与硫酸亚铁铵发生反应,这样会使消耗的硫酸亚铁铵偏大,那么最终求出的纯度也偏大。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】下表是A、B、C、D、E 五种有机物的有关信息:
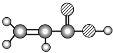
A | ①能使溴的四氯化碳溶液褪色;②空间充填模型 |
B | ① 由 C、H 两种元素组成;②空间充填模型为 |
C | ① 由 C、H、O 三种元素组成;②能与 Na 反应,但不能与 NaOH 溶液反应;③ 能与 E 反应生成酯 |
D | ① 相对分子质量比 C 少 2;②能由 C 氧化而成 |
E | ① 由 C、H、O 三种元素组成;②球棍模型为 |
回答下列问题:
(1)A 在一定条件下发生聚合反应生成的高分子化合物的名称为_____。
(2)A 与氢气发生加成反应后生成 F,与 F 在分子组成和结构上相似的有机物有很多,它们均符合通式CnH2n+2(n为正整数)。当 n=_____时,这类有机物开始出现同分异构体。
(3)B 具有的性质是_____(填序号)。
①无色无味液体 ②密度比水的大 ③难溶于水 ④有毒 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥在一定条件下可与氢气反应
(4)在铁作用下,B 与液溴反应的化学方程式为_____。
(5)C能与E反应生成 酯 ,该反应的反应类型为_________; 其化学方程式为_______。
(6)由C氧化生成D 的化学方程式为_______。