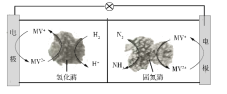
题目内容
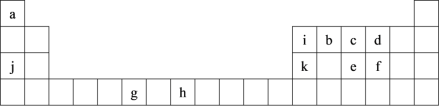
【题目】下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式______,h2+中未成对电子数为____。
(2)在b2a2分子中,元素b为__杂化,该分子是___分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为____。
(3)bd2与bf2比较,沸点较高的是___(填分子式),原因是_______。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是___。
A h位于元素周期表中第四周期第VIII族,属于d区元素
B e的基态原子中,3p能级为半充满,属于p区元素
C 最外层电子排布式为4s2,一定属于IIA族
D 最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)i元素最高价含氧酸是一元弱酸,它的水溶液之所以呈弱酸性并非本身能电离出H+,而是它加合了一个OH-,形成配位键,请用“→”表示);请用离子方程式表示____与ia4-互为等电子体的一种阳离是____,ia4-的空间构型为___。
(6)下表是一些气态原子逐级电离能(kJ·mol-1):

①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量___________
②表中X可能为以上元素中的____元素(填写元素符号)。Y与X的最高价氧化物的水化物溶液反应的离子方程式为______
【答案】1s22s22p63s23p63d54s1 4 sp 非极性 3:2 CS2 相对分子质量大,分子间作用力(范德华力)大 AB 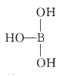 +H2O
+H2O![]()
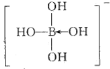 +H+ NH4+ 正四面体 Li原子失去一个电子后,Li+已形成稳定结构,此时再失去一个电子很困难 Na 2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑
+H+ NH4+ 正四面体 Li原子失去一个电子后,Li+已形成稳定结构,此时再失去一个电子很困难 Na 2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑
【解析】
各编号对应的元素,在表中表示出。
aH | |||||||||||||||||
iB | bC | cN | dO | ||||||||||||||
jNa | kAl | eP | fS | ||||||||||||||
gCr | hFe |
(1)g为Cr元素,原子核外电子数目为24,核外电子排布式为1s22s22p63s23p63d54s1,h为Fe,Fe2+核外电子排布式为1s22s22p63s23p63d6,根据洪特原则,3d轨道中未成对电子数为4;
(2)b2a2为:C2H2,元素C为sp杂化,该分子是非极性分子,该分子中含有2个C-H单键和1个碳碳三键。C—H键σ键,碳碳三键中,有1个键为σ键,其他2个为π键,则σ键共3个,π键共2个,比例为3:2;
(3)CO2与CS2比较,CS2的熔沸点高,因为:分子结构相似,为分子晶体,分子晶体的熔沸点高低取决于相对分子质量的大小,故答案为:CS2; 相对分子质量大,分子间作用力(范德华力)大;
(4)A.h是Fe元素位于元素周期表中第四周期ⅤⅢ族,属于d区元素,故A正确;
B.e原子的基态原子中3p能级为半充满,属于p区元素,故B正确;
C.最外层电子排布式为4s2,可能处于ⅡA族、ⅡB族,故C错误;
D.最外层电子排布式为ns2np1,该元素处于ⅢA族,故D错误;
故答案为:AB;
(5)i为B,它的最高价氧化物为H3BO3,根据信息,离子方程式为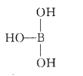 +H2O
+H2O![]()
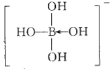 +H+;BH4-的等电子体,为阳离子的是NH4+,等电子体的空间结构相同,NH4+为正四面体,则BH4-也为正四面体;
+H+;BH4-的等电子体,为阳离子的是NH4+,等电子体的空间结构相同,NH4+为正四面体,则BH4-也为正四面体;
(6) Li原子失去一个电子后,Li+的电子排布为1s2,已形成稳定结构,此时再失去一个电子很困难,所以第二电离能比第一电离能大;X的第二电离能远大于第一电离能,则X的化合价为+1价,但是X的第一电离能比Li的小,说明更容易失去电子,则X为Na;Y的第四电离能远大于第三电离能,Y的化合价为+3价,Y为Al,X的最高价氧化物的水化物为NaOH,方程式为2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
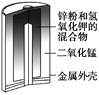
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】无水氯化锰![]() 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入![]() 溶液,充分反应后加入
溶液,充分反应后加入![]() 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入![]() 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
|
|
| |
初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤I中:
①Fe2+浓度降,滤渣中存在![]() 。结合离子方程式解释原因:_______。
。结合离子方程式解释原因:_______。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______。
(3)步骤II中:
①![]() 酸性溶液的作用:_______。
酸性溶液的作用:_______。
②结合离子方程式说明MnCO3的作用: _______。
(4)步骤III通入H2S后, Ni2+不达标而![]() 达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
(5)测定无水![]() 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量![]() ,使
,使![]() 氧化为
氧化为![]() 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵![]() 滴定
滴定![]() ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①样品中MnCl2的质量分数是_____(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的![]() 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
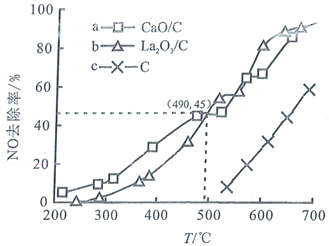
【题目】用活性炭还原法可以处理氮氧化物。某研究小组向2L密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
时间/t(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
A. 10~20 min内,NO的平均反应速率为0.018mol/(Lmin)
B. T1℃时,该反应的平衡常数K=0.25
C. 保持与前30min的反应条件相同,再向容器中加入2molN2和2molNO,则平衡向左移动
D. 30min后,只改变了一个条件,根据上述表格判断,该条件可能为缩小容器体积