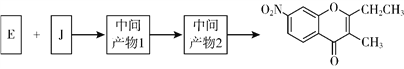
题目内容
【题目】下表是A、B、C、D、E 五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②空间充填模型 |
B | ① 由 C、H 两种元素组成;②空间充填模型为 |
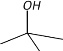
C | ① 由 C、H、O 三种元素组成;②能与 Na 反应,但不能与 NaOH 溶液反应;③ 能与 E 反应生成酯 |
D | ① 相对分子质量比 C 少 2;②能由 C 氧化而成 |
E | ① 由 C、H、O 三种元素组成;②球棍模型为 |
回答下列问题:
(1)A 在一定条件下发生聚合反应生成的高分子化合物的名称为_____。
(2)A 与氢气发生加成反应后生成 F,与 F 在分子组成和结构上相似的有机物有很多,它们均符合通式CnH2n+2(n为正整数)。当 n=_____时,这类有机物开始出现同分异构体。
(3)B 具有的性质是_____(填序号)。
①无色无味液体 ②密度比水的大 ③难溶于水 ④有毒 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥在一定条件下可与氢气反应
(4)在铁作用下,B 与液溴反应的化学方程式为_____。
(5)C能与E反应生成 酯 ,该反应的反应类型为_________; 其化学方程式为_______。
(6)由C氧化生成D 的化学方程式为_______。
【答案】聚乙烯 4 ①③④⑥ ![]() +Br2
+Br2![]()
![]() +HBr 酯化(取代)反应 CH3CH2OH+CH2=CHCOOH
+HBr 酯化(取代)反应 CH3CH2OH+CH2=CHCOOH![]() CH2=CHCOOCH2CH3+H2O 2CH3CH2OH+O2
CH2=CHCOOCH2CH3+H2O 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
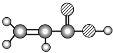
根据题干信息,B由C、H两种元素组成,空间充填模型为![]() ,则B为苯,E由C、H、O三种元素组成,球棍模型为
,则B为苯,E由C、H、O三种元素组成,球棍模型为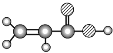 ,则E为CH2=CHCOOH,C由C、H、O 三种元素组成,能与Na反应,但不能与NaOH溶液反应,能与E反应生成酯,则C为一种醇,A能使溴的四氯化碳溶液褪色,空间充填模型
,则E为CH2=CHCOOH,C由C、H、O 三种元素组成,能与Na反应,但不能与NaOH溶液反应,能与E反应生成酯,则C为一种醇,A能使溴的四氯化碳溶液褪色,空间充填模型![]() ,能与水在一定条件下反应生成,则A为CH2=CH2,C为CH3CH2OH,D的相对分子质量比C少2,能由C氧化而成,则D为CH3CHO,据此分析解答。
,能与水在一定条件下反应生成,则A为CH2=CH2,C为CH3CH2OH,D的相对分子质量比C少2,能由C氧化而成,则D为CH3CHO,据此分析解答。
(1)根据上述分析可知,A为乙烯(CH2=CH2),在一定条件下发生聚合反应生成的高分子化合物的名称为聚乙烯;
(2)乙烯与氢气发生加成反应后生成乙烷,与乙烷在分子组成和结构上相似的有机物有很多,它们均符合通式CnH2n+2(n为正整数),当n=4时,这类有机物开始出现同分异构体;
(3)B为苯,苯是一种无色无味、密度比水小、难溶于水的有毒液体,苯不能与酸性高锰酸钾溶液和溴水反应褪色,苯在一定条件下可与氢气发生加成反应生成环己烷,故答案选①③④⑥;
(4)在Fe的作用下,苯与液溴发生取代反应生成溴苯,反应的化学方程式为![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(5)C(CH3CH2OH)可与E(CH2=CHCOOH)发生酯化(取代)反应生成CH2=CHCOOCH2CH3,化学方程式为CH3CH2OH+CH2=CHCOOH![]() CH2=CHCOOCH2CH3+H2O;
CH2=CHCOOCH2CH3+H2O;
(6)CH3CH2OH催化氧化生成CH3CHO,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用降温结晶的方法可将叔丁醇从二者的混合物中结晶出来
D. 两种醇发生消去反应后得到同一种烯烃
【题目】无水氯化锰![]() 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入![]() 溶液,充分反应后加入
溶液,充分反应后加入![]() 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入![]() 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
|
|
| |
初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤I中:
①Fe2+浓度降,滤渣中存在![]() 。结合离子方程式解释原因:_______。
。结合离子方程式解释原因:_______。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______。
(3)步骤II中:
①![]() 酸性溶液的作用:_______。
酸性溶液的作用:_______。
②结合离子方程式说明MnCO3的作用: _______。
(4)步骤III通入H2S后, Ni2+不达标而![]() 达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
(5)测定无水![]() 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量![]() ,使
,使![]() 氧化为
氧化为![]() 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵![]() 滴定
滴定![]() ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①样品中MnCl2的质量分数是_____(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的![]() 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。