题目内容
【题目】K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑、FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4、2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O、2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O。回答下列问题:
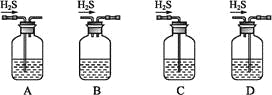
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是_____。
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40 ℃,理由是_______;得到K3[Fe(C2O4)3]溶液后,加入乙醇的理由是________。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤__________(叙述此步操作),⑥计算。步骤③若未在干燥器中进行,测得的晶体中所含结晶水含量____(填“偏高”“偏低”或“无影响”);步骤⑤的目的是_______________。
(4)晶体中C2O42-含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
①下列操作及说法正确的是___。
A.滴定管用蒸馏水洗涤后,即可装入标准溶液
B.装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量标准液,使尖嘴充满液体
C.接近终点时,需用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴
②有同学认为该滴定过程不需要指示剂,那么滴定终点的现象为________,若达到滴定终点消耗高锰酸钾溶液V mL,那么晶体中所含C2O42-的质量分数为____(用含V、m的式子表示)。
【答案】A 防止H2O2分解 三草酸合铁(Ⅲ)酸钾在乙醇中溶解度小 重复②~④步操作至恒重 偏低 检验晶体中的结晶水是否已全部失去 B 当滴入最后一滴KMnO4溶液,锥形瓶中溶液恰好由无色变为浅红色,且半分钟不褪色 ![]()
【解析】
(1)A.该装置中硫化氢与氢氧化钠溶液接触面积大,从而使硫化氢吸收较完全,且该装置中气压较稳定,不产生安全问题,故A正确;
B.硫化氢与氢氧化钠接触面积较小,所以吸收不完全,故B错误;
C.没有排气装置,导致该装置内气压增大而产生安全事故,故C错误;
D.该装置中应遵循“长进短出”的原理,故D错误;
故选A;
(2)双氧水不稳定,温度高时,双氧水易分解,为防止双氧水分解,温度应低些;根据相似相溶原理知,三草酸合铁酸钾在乙醇中溶解度小,所以得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入无水乙醇;
(3)晶体中所含结晶水可通过重量分析法测定,步骤⑤的目的是检验晶体中的结晶水是否已全部失去,也叫恒重操作;步骤③未在干燥器中进行,晶体中结晶水不能全部失去,所以称量出的水的质量偏小,测得的晶体中所含结晶水含量也偏低;
(4)①A.滴定管用蒸馏水洗涤后,需要用标准液润洗,然后在装入标准溶液,A错误;
B.装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量标准液,使尖嘴充满液体,B正确;
C.接近终点时,不需用蒸馏水冲滴定管尖端悬挂的液滴,否则会导致测定结果偏高,C错误;
答案选B;
②由于酸性高锰酸钾溶液显紫红色,则终点的实验现象为当滴入最后一滴KMnO4溶液,锥形瓶中溶液恰好由无色变为浅红色,且半分钟不褪色;n(MnO4-)=V×10-3L×0.0100 mol·L-1,根据方程式可知n(C2O42-)=n(MnO4-)×![]() ×10-5mol,m(C2O42-)=
×10-5mol,m(C2O42-)=![]() ×10-5mol×88 g·mol-1=2.75V×10-2g,所以晶体中所含C2O42-的质量分数为2.75V/100m。
×10-5mol×88 g·mol-1=2.75V×10-2g,所以晶体中所含C2O42-的质量分数为2.75V/100m。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
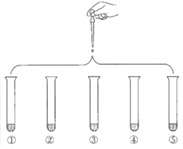
名题金卷系列答案【题目】将5mL 0.005mol/L FeCl3溶液和5mL 0.015mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol/L KCl溶液,振荡 | |
实验④:滴加4滴1 mol/L KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol/L NaOH溶液,振荡 |
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动