题目内容
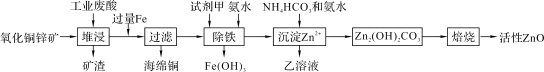
【题目】某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃氧化铜锌矿制取活性ZnO的方案如图。
已知:298 K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)____Ksp(ZnS)(选填“>”、“<”或“=”)。
(2)除铁过程中试剂甲最好选用____(填序号)。
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在____范围之间。
(4)试写出沉淀Zn2+时发生反应的离子方程式:____。
【答案】(1)<;(2)B;(3)3.2≤pH<6.2(或3.2 ~ 6.2);(4)2Zn2++3NH3H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O。
【解析】
试题分析:(1)相同类型的电解质,Ksp越大,其在水中的溶解度能力越强,ZnS溶解,而CuS不溶解,说明Ksp(CuS)<Ksp(ZnS);(2)除杂过程中,不要引入新杂质,H2O2是绿色氧化剂,产物是水,不会产生新的杂质,故选项B正确;(3)H2O2把Fe2+全部转化成Fe3+,根据数据Fe3+全部转变成沉淀,调节pH≥3.2,但不能使Zn2+转变成沉淀,则调节pH<6.2,因此范围是3.2≤pH<6.2;(4)根据流程图,离子反应方程式为:2Zn2++3NH3H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O。

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目