题目内容
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:

(1)SO2对环境的危害主要是形成 。
(2)用Na2CO3溶液能吸收SO2的原因是 。
(3)查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中发生如下反应:
①2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3
②2NaHCO3+ SO2+H2O=2CO2↑+Na2SO3
③Na2SO3+ SO2+H2O=2NaHSO3
溶液中有关组分的质量分数变化如图是所示,图中的线2表示的组分为 (填化学式)。

(4)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(5)获得的Na2SO3产品久置后质量变重,主要原因是 。
【答案】(1)酸雨
(2)亚硫酸的酸性比碳酸强(或Na2CO3溶液呈碱性)
(3)NaHCO3
(4)NaHSO3+NaOH=Na2SO3+H2O
(5)Na2SO3易被氧化成Na2SO4
【解析】
试题分析:(1)二氧化硫可以形成酸雨;(2)二氧化硫溶于水后生成亚硫酸,亚硫酸的酸性比碳酸强所以二氧化硫能与碳酸钠反应生成二氧化碳;(3)线2表示的物质先增加,后减小,当其消失时会出现另一种物质,结合方程式分析,只有碳酸氢钠符合题意,反应先生成碳酸氢钠,后碳酸氢钠与二氧化硫反应逐渐减少,当碳酸氢钠完全反应后才产生亚硫酸氢钠,故答案为:NaHCO3;(4)加入氢氧化钠是为了和亚硫酸氢钠反应生成亚硫酸钠,反应的方程式为:NaHSO3+NaOH=Na2SO3+H2O;(5)Na2SO3易被氧化成Na2SO4,物质的质量增加。

【题目】某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃氧化铜锌矿制取活性ZnO的方案如图。
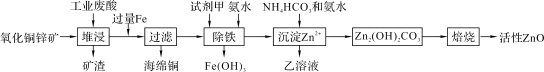
已知:298 K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)____Ksp(ZnS)(选填“>”、“<”或“=”)。
(2)除铁过程中试剂甲最好选用____(填序号)。
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在____范围之间。
(4)试写出沉淀Zn2+时发生反应的离子方程式:____。
【题目】在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
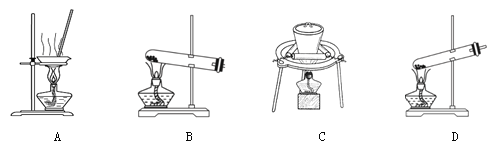
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论: 。 |
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察; | 现象: ; 结论:样品中含有NaHCO3。 |
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察。 | 现象: ; 结论: 。 |


