��Ŀ����
����Ŀ��������ѧ֪ʶ�ش��������⣺
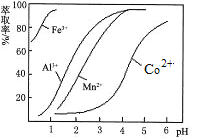
��1�������ӷ���ʽ��ʾ�μ�������϶�Na2CO3���ʼ��Ե�ԭ��____________����ͬŨ�ȵ�Na2CO3��Һ��NaHCO3��Һ�������Ϻ���Һ��c��HCO3-�� ____c��CO32-�����á���������=����ʾ����
��2������ʱ��AlCl3��Һ��____������ᡱ��������С�������AlCl3��Һ���ɣ����գ��õ��Ĺ��������________��AlCl3��Һ��NaHCO3��Һ���ʱ������Ӧ�����ӷ���ʽΪ____________________��
���𰸡���1��CO32-��H2O![]() HCO3-��OH-�� �� ����2���Al2O3��Al3+��3HCO3-��Al��OH��3����3CO2����
HCO3-��OH-�� �� ����2���Al2O3��Al3+��3HCO3-��Al��OH��3����3CO2����
��������
�����������1��Na2CO3����ǿ�������Σ�CO32������ˮ�⣬CO32����H2O![]() HCO3����OH����HCO3����H2O
HCO3����OH����HCO3����H2O![]() H2CO3��OH������������ˮ����ɣ�Խ��Խˮ�⣬CO32��ˮ����������HCO3����ˮ����������c��CO32������c��HCO3��������2��AlCl3����ǿ�������Σ�������ˮ�⡢˭ǿ��˭�ԣ���ˮ��Һ�����ԣ�AlCl3��3H2O
H2CO3��OH������������ˮ����ɣ�Խ��Խˮ�⣬CO32��ˮ����������HCO3����ˮ����������c��CO32������c��HCO3��������2��AlCl3����ǿ�������Σ�������ˮ�⡢˭ǿ��˭�ԣ���ˮ��Һ�����ԣ�AlCl3��3H2O![]() Al��OH��3��3HCl������HCl�ӷ����ٽ�ˮ�⣬�õ������������������������ֽ����������ˮ�����߷���˫ˮ�⣬���ӷ�Ӧ����ʽΪ��Al3+��3HCO3-��Al��OH��3����3CO2����
Al��OH��3��3HCl������HCl�ӷ����ٽ�ˮ�⣬�õ������������������������ֽ����������ˮ�����߷���˫ˮ�⣬���ӷ�Ӧ����ʽΪ��Al3+��3HCO3-��Al��OH��3����3CO2����

 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�����Ŀ��ij����С����Ƴ����ù�ҵ��������10%��H2SO4���ͷ�������ͭп����ȡ����ZnO�ķ�����ͼ��
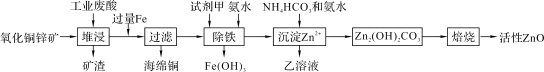
��֪��298 Kʱ�����ӿ�ʼ��������ȫ����ʱ��pH���±���ʾ��
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
��ش��������⣺
��1����H2SO4�����¿�ʯ�к��е�ZnS�ܽ��CuS���ܣ�����������ͬ�¶��£�Ksp��CuS��____Ksp��ZnS����ѡ���������������������
��2�������������Լ������ѡ��____�����������
A��KMnO4 B��H2O2 C��HNO3 D��Cl2
��3�����������м��백ˮ��Ŀ���ǵ���pH��____��Χ֮�䡣
��4����д������Zn2+ʱ������Ӧ�����ӷ���ʽ��____��