题目内容
【题目】前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族。F是第四周期未成对电子最多的原子,G是目前使用量最多的金属。
请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为 ,B、C、D三种元素的第一电离能从大到小的顺序为 。
(2)![]() 中B原子的杂化方式为 ,该离子的空间构型为________
中B原子的杂化方式为 ,该离子的空间构型为________
(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式 ,化合物ABC中σ键和π键数目之比为 ,C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因 。
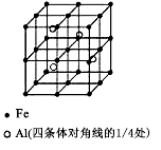
(4)E和G形成的某种晶胞如下图所示:其中白球表示E,黑球表示G。则该物质的化学式为 ,假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为 cm 。
【答案】(1)3d54s1;N>O>C
(2)sp2杂化;平面正三角形
(3)NH4NO3或者NH4NO2;1∶1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大。
(4)FeS;![]()
【解析】试题分析:前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,A为H元素;B元素具有三个能级且所排电子数相同,B为C元素;D元素2p能级上电子数是2s能级的两倍,D为O元素,则C为N元素;D和E相邻且同主族,E为S元素。F是第四周期未成对电子最多的原子,F为Cr元素,G是目前使用量最多的金属,G为Fe元素。
(1)F为Cr元素,价电子排布式为3d54s1,N元素的2p为半充满状态,较为稳定,第一电离能最大,B、C、D三种元素的第一电离能从大到小的顺序为N>O>C,故答案为:3d54s1;N>O>C;
(2)C![]() 中C原子与3个O原子相连,孤电子对数=
中C原子与3个O原子相连,孤电子对数=![]() ×(4+2-2×3)=0,,杂化方式为sp2杂化,该离子的空间构型为平面正三角形,故答案为:sp2杂化;平面正三角形;
×(4+2-2×3)=0,,杂化方式为sp2杂化,该离子的空间构型为平面正三角形,故答案为:sp2杂化;平面正三角形;
(3)NH4NO3或者NH4NO2由A、C、D组成且既含离子键又含共价键的物质,化合物HCN的结构为H—C≡N,含有2个σ键和2个π键,数目之比为1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大,故答案为:NH4NO3或者NH4NO2;1∶1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大;
(4)白球的数目为8×![]() +6×
+6×![]() =4,黑球的数目为4,个数比为1:1,化学式为FeS;1mol晶体的质量为88g,含有
=4,黑球的数目为4,个数比为1:1,化学式为FeS;1mol晶体的质量为88g,含有![]() 个晶胞,设晶胞的边长为x,则
个晶胞,设晶胞的边长为x,则![]() ×x3×ρ g/cm3=88g,则x=
×x3×ρ g/cm3=88g,则x=![]() cm,根据晶胞结构图,晶胞中距离最近的G原子之间的距离为晶胞面对角线的一半,因此晶胞中距离最近的G原子之间的距离为
cm,根据晶胞结构图,晶胞中距离最近的G原子之间的距离为晶胞面对角线的一半,因此晶胞中距离最近的G原子之间的距离为![]()
![]() cm,故答案为:FeS;
cm,故答案为:FeS;![]()
![]() 。
。

 阅读快车系列答案
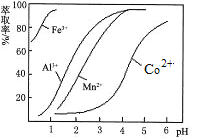
阅读快车系列答案【题目】某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃氧化铜锌矿制取活性ZnO的方案如图。
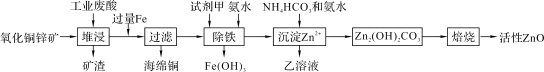
已知:298 K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)____Ksp(ZnS)(选填“>”、“<”或“=”)。
(2)除铁过程中试剂甲最好选用____(填序号)。
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在____范围之间。
(4)试写出沉淀Zn2+时发生反应的离子方程式:____。