题目内容
【题目】现利用下图所示装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。

(1)装置B中发生反应的化学方程式是:_______________________
(2)装置D中碱石灰的作用是________________
(3)停止反应,待B管冷却后,取其中的固体,加人过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________________________。
(4)为利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
①物质A可以是__________,作用是 ______________。
A.酸性高锰酸钾溶液
B.盐酸
C.硝酸
D.双氧水
E.氯气
② 中从FeCl3稀溶液到FeCl3·6H2O晶体的主要操作包括蒸发浓缩、降温结晶、过滤,该流程中需保持盐酸过量,主要原因是:(结合离子方程式简要说明)_______________________________________。
【答案】(1)4H2O(g)+3Fe ![]() Fe3O4 +4H2
Fe3O4 +4H2
(2)干燥
(3)取滤液置于试管中,加入几滴KSCN溶液,若溶液变为血红色,则说明有Fe3+
(4)① DE 使Fe2+转化为Fe3+
② Fe3++3H2O![]() Fe(OH)3+3H+ 过量的HCl可抑制Fe3+的水解。
Fe(OH)3+3H+ 过量的HCl可抑制Fe3+的水解。
【解析】
试题分析:(1)装置B中铁与水蒸气发生反应产生四氧化三铁和氢气,发生反应的化学方程式是4H2O(g)+Fe ![]() Fe3O4 +4H2;(2)装置D中碱石灰的作用是吸收氢气中的水蒸气,干燥氢气,便于检验氢气是否可以与CuO发生反应;(3) B是Fe3O4,与盐酸发生反应:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;检验该溶液中含有Fe3+的方法是取滤液置于试管中,加入几滴KSCN溶液,若溶液变为血红色,则说明有Fe3+;(4) 滤液中含有FeCl3、FeCl2,要使其完全转化为FeCl3溶液,应该加入具有强氧化性的物质,同时不能引入杂质离子。A.酸性高锰酸钾溶液具有强氧化性,但是不引入杂质离子,错误;B.盐酸无强的氧化性,不能产生氯化铁,错误;C.硝酸有有强氧化性,但是不引入杂质离子,错误;D.双氧水有强氧化性,不引入杂质离子,正确;E.氯气有强氧化性,不引入杂质离子,正确;选项是DE,他们的作用是使Fe2+转化为Fe3+;②中从FeCl3稀溶液到FeCl3·6H2O晶体的主要操作包括蒸发浓缩、降温结晶、过滤,该流程中需保持盐酸过量,主要原因是:该盐是强酸弱碱盐,在溶液中Fe3+发生水解反应Fe3++3H2O
Fe3O4 +4H2;(2)装置D中碱石灰的作用是吸收氢气中的水蒸气,干燥氢气,便于检验氢气是否可以与CuO发生反应;(3) B是Fe3O4,与盐酸发生反应:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;检验该溶液中含有Fe3+的方法是取滤液置于试管中,加入几滴KSCN溶液,若溶液变为血红色,则说明有Fe3+;(4) 滤液中含有FeCl3、FeCl2,要使其完全转化为FeCl3溶液,应该加入具有强氧化性的物质,同时不能引入杂质离子。A.酸性高锰酸钾溶液具有强氧化性,但是不引入杂质离子,错误;B.盐酸无强的氧化性,不能产生氯化铁,错误;C.硝酸有有强氧化性,但是不引入杂质离子,错误;D.双氧水有强氧化性,不引入杂质离子,正确;E.氯气有强氧化性,不引入杂质离子,正确;选项是DE,他们的作用是使Fe2+转化为Fe3+;②中从FeCl3稀溶液到FeCl3·6H2O晶体的主要操作包括蒸发浓缩、降温结晶、过滤,该流程中需保持盐酸过量,主要原因是:该盐是强酸弱碱盐,在溶液中Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+ ,使溶液显酸性,为了抑制盐的水解,同时不引入杂质离子,所以要在HCl的气氛中加热。
Fe(OH)3+3H+ ,使溶液显酸性,为了抑制盐的水解,同时不引入杂质离子,所以要在HCl的气氛中加热。

【题目】某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃氧化铜锌矿制取活性ZnO的方案如图。
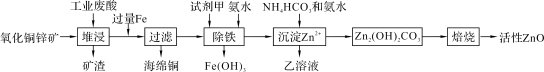
已知:298 K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)____Ksp(ZnS)(选填“>”、“<”或“=”)。
(2)除铁过程中试剂甲最好选用____(填序号)。
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在____范围之间。
(4)试写出沉淀Zn2+时发生反应的离子方程式:____。