题目内容
14.对于钠的卤化物(NaX)和硅的卤化物分子(SiX4),下列叙述正确的是( )| A. | SiX4呈空间网状结构,硬度大 | |
| B. | NaX的熔点一般高于SiX4 | |
| C. | NaX易水解 | |
| D. | SiX4由原子构成,熔化时破坏共价键 |
分析 钠的卤化物(NaX)为离子化合物属于离子晶体,硅的卤化物(SiX4)为共价化合物其晶体为分子晶体,结合离子化合物及共价化合物的性质分析.
解答 解:A、硅的卤化物(SiX4)属于分子晶体,不是空间网状结构,其硬度较小,故A错误;
B、钠的卤化物(NaX)为离子化合物属于离子晶体,硅的卤化物(SiX4)为共价化合物属于分子晶体,离子晶体的熔点大于分子晶体的熔点,即NaX的熔点一般高于SiX4,故B正确;
C、钠的强酸盐不水解,NaX(NaF除外)不易水解,故C错误;
D、硅的卤化物(SiX4)是由分子构成的,属于分子晶体,熔化时破坏分子间作用力,故D错误;
故选:B.
点评 本题考查了离子晶体和分子晶体的物理性质、硅的卤化物和钠的卤化物的化学性质,题目难度不大,注意根据晶体的类型来判断物质的熔点的高低.

练习册系列答案
相关题目
5.短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是( )
| W | X | ||
| Y | Z |
| A. | W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料 | |
| B. | Z元素的最高价氧化物水化物的酸性强于Y | |
| C. | 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定 | |
| D. | 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性 |
2.分子式为C8H11N的有机物,分子内含有苯环和氨基(-NH2)的同分异构体共有( )
| A. | 13种 | B. | 12种 | C. | 14种 | D. | 9种 |
9.根据有机化合物的命名规则,下列命名正确的是( )
| A. | 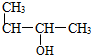 1-甲基-2-丙醇 | B. | 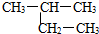 2-甲基丁烷 | C. |  1,2,3-甲基丙烷 | D. | 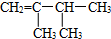 2,3-甲基-3-丁烯 |
19.常温下,测得某溶液NaHX的pH>7,该溶液中有关浓度关系式正确的是( )
| A. | c(Na+)>c(H+)+c(X2-) | B. | c(Na+)=c(H2X)+c(HX-)+c(X2-) | ||
| C. | c(X2-)>c(H2X) | D. | c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) |
3.下列各组离子在水溶液能大量共存的是( )
| A. | Cu2+、K+、OH-、SO42- | B. | Na+、Ca2+、HCO3-、Cl- | ||
| C. | NH4+、Al3+、AlO2-、H+ | D. | SO32-、Ba2+、H+、NO3- |
4.某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等.为确定该溶液X的成分,某学习小组做了如下实验:
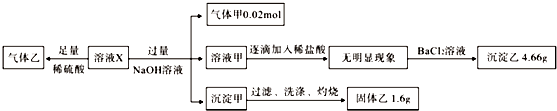
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 若含有Fe3+,则一定含有Cl- | |
| B. | SO42-、NH4+一定存在,NO3-、Cl-可能不存在 | |
| C. | CO32-、Al3+、K+一定不存在 | |
| D. | 气体甲、沉淀甲一定为纯净物 |
 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和.另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题.
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和.另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题.