题目内容
15.下列说法正确的是( )| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 乙醇与浓硫酸混合,加热至170°C制乙烯的反应属于取代反应 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
分析 A.乙烯和溴发生加成反应,乙烯能被酸性高锰酸钾溶液氧化;
B.乙醇和浓硫酸加热至170℃制乙烯的反应属于消去反应;
C.乙醇被重铬酸钾溶液氧化生成乙酸;
D.可将乙醇拆写成C2H4•H2O的形式来分析.
解答 解:A.乙烯和溴发生加成反应,乙烯能被酸性高锰酸钾溶液氧化,所以二者反应类型不同,故A错误;
B.乙醇和浓硫酸加热至170℃制乙烯时还生成水,该反应属于消去反应,故B错误;
C.乙醇被重铬酸钾溶液氧化生成乙酸,所以该反应属于氧化反应,故C正确;
D.乙醇可拆写成C2H4•H2O的形式,等质量的C2H4和C2H4•H2O含C2H4,乙烯高于乙醇,故消耗氧气的量乙烯大于乙醇,故D错误.
故选C.
点评 本题考查乙烯、乙醇的性质,明确物质中官能团与性质的关系是解本题关键,知道取代反应、加成反应、消去反应的区别,题目难度不大.

练习册系列答案
相关题目
5.短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是( )
| W | X | ||
| Y | Z |
| A. | W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料 | |
| B. | Z元素的最高价氧化物水化物的酸性强于Y | |
| C. | 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定 | |
| D. | 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性 |
3.下列各组离子在水溶液能大量共存的是( )
| A. | Cu2+、K+、OH-、SO42- | B. | Na+、Ca2+、HCO3-、Cl- | ||
| C. | NH4+、Al3+、AlO2-、H+ | D. | SO32-、Ba2+、H+、NO3- |
10.80℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | pH=3的碳酸中:c(H+)=3.0mol•L-1 | |
| B. | 饱和乙酸钠溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH为2的盐酸中:c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=13的烧碱溶液中:c(OH-)=1.0×10-1mol•L-1 |
20.短周期元素X、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
7.下列指定反应的离子方程式正确的是( )
| A. | Cu与浓硝酸反应制备NO2:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-═AlO2-+2H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
4.某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等.为确定该溶液X的成分,某学习小组做了如下实验:
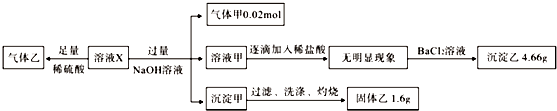
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 若含有Fe3+,则一定含有Cl- | |
| B. | SO42-、NH4+一定存在,NO3-、Cl-可能不存在 | |
| C. | CO32-、Al3+、K+一定不存在 | |
| D. | 气体甲、沉淀甲一定为纯净物 |
5.下列有关实验原理或操作正确的是( )
| A. | 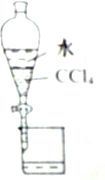 分离CCl4和水 | |
| B. |  洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. | 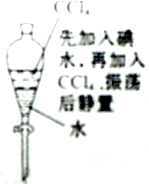 液体分层,下层呈无色 | |
| D. | 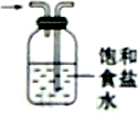 除去氯气中的氯化氢 |