题目内容
【题目】取表面部分氧化的镁条8.00g溶于250mL4.00mol·L-1的稀盐酸中,向所得溶液中滴加未知浓度的NaOH溶液,产生沉淀的质量与NaOH溶液的体积关系如图所示:

请计算:
(1)NaOH溶液的物质的量浓度___mol·L-1。
(2)样品中镁元素的质量___g。
【答案】8.00 7.68
【解析】
在实验过程中发生反应的方程式为:
MgO+2HCl=MgCl2+H2O,Mg+2HCl=MgCl2+H2↑
HCl+NaOH=NaCl+H2O,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,据此分析解答。
(1)从图象上看,生成沉淀的最高点时,所得溶液为NaCl溶液,从此点可以看出
n(NaOH)=n(HCl),![]()
答案为:8.00mol/L;
(2)由图中可知,m[Mg(OH)2]=18.56g,
则![]()
答案为7.68。

【题目】为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 ![]() CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验 序号 | 温度/℃ | 初始CCl4的浓度 (mol·L-1) | 初始H2的浓度 (mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为_____________。
②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值________(填序号)。
A 等于50% B 大于50% C 小于50% D 从本题资料无法判断
(2)120 ℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。
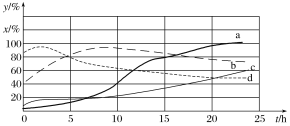
①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填序号)。
②根据上图曲线,氢气的起始浓度为________ mol·L