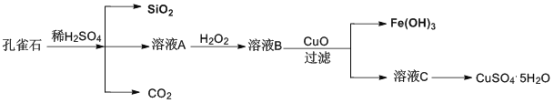题目内容
【题目】为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 ![]() CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验 序号 | 温度/℃ | 初始CCl4的浓度 (mol·L-1) | 初始H2的浓度 (mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为_____________。
②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值________(填序号)。
A 等于50% B 大于50% C 小于50% D 从本题资料无法判断
(2)120 ℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填序号)。
②根据上图曲线,氢气的起始浓度为________ mol·L
【答案】K=c(CHCl3)c(HCl)/[c(CCl4)c(H2)] 大于 0.05 mol·L-1·h-1 D c 4
【解析】
(1)①因CCl4的沸点为77℃,CHCl3的沸点为61.2℃,所以在110℃或100℃反应时各物质均为气态,根据平衡常数的表达式书写;
②110℃时,由实验2可知反应中各物质的平衡浓度均为0.5mol/L,代入表达式计算得平衡常数;实验1和实验2的反应温度相同,所以其平衡常数相同,利用平衡常数相等,可以求出实验1中CCl4的平衡转化率,然后与50%比较;
③根据v=![]() 计算v(H2);
计算v(H2);
④对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小;
(2)①氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,据此判断;
②根据图像分析判断出氢气的浓度对CCl4的平衡转化率和产物中CHCl3的百分含量的影响再判断。
(1)①因CCl4的沸点为77℃,CHCl3的沸点为61.2℃,所以在110℃或100℃反应时各物质均为气态,CCl4+H2 ![]() CHCl3+HCl的平衡常数K=
CHCl3+HCl的平衡常数K=![]() ,故答案为:
,故答案为:![]() ;
;
②110℃时,实验2中,10h后达到平衡,CCl4的转化率为50%,
CCl4(g)+H2(g)CHCl3(g)+HCl(g),
起始(mol/L): 1 1 0 0
变化(mol/L):0.5 0.5 0.5 0.5
平衡(mol/L):0.5 0.5 0.5 0.5
则平衡常数K=![]() =1,
=1,
实验1中,设平衡时四氯化碳的浓度变化量为amol/L,则:
CCl4(g)+H2(g)CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则![]() =1,解得a=0.48,则CCl4的转化率为
=1,解得a=0.48,则CCl4的转化率为![]() ×100%=60%>50%,故答案为:大于;
×100%=60%>50%,故答案为:大于;
③由②中计算可知,平衡时氢气的浓度变化量为0.5mol/L,则v(H2)=![]() =0.05mol/(Lh),故答案为:0.05mol/(Lh);
=0.05mol/(Lh),故答案为:0.05mol/(Lh);
④对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小,故答案为:D;
(2)①由图像可知,氢气浓度越大,反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2起始浓度为2mol/L时,消耗CCl4的百分率变化曲线是c,故答案为:c;
②由图像可知,a、b表示氢气的浓度为4mol/L的曲线,c、d表示氢气的浓度为2mol/L的曲线,从图中可见,4mol/L的a、b曲线比2mol/L的c、d曲线CCl4转化率和产物中CHCl3的百分率的数值均高,即氢气的起始浓度为4mol·L-1时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量,故答案为:4。

 阅读快车系列答案
阅读快车系列答案【题目】下表给出了14种元素的电负性:
元素 | 电负性 | 元素 | 电负性 | 元素 | 电负性 |
Al | 1.5 | B | 2.0 | Be | 1.5 |
C | 2.5 | Cl | 3.0 | F | 4.0 |
Li | 1.0 | Mg | 1.2 | N | 3.0 |
Na | 0.9 | O | 3.5 | P | 2.1 |
Cl | 2.5 | S | 1.8 |
(1)同一周期中,从左到右,主族元素的电负性_________;同一主族中,从上到下,元素的电负性_________。主族元素的电负性随原子序数递增呈_________变化。
(2)短周期元素中,电负性最大的元素与电负性最小的元素形成的化合物属于____________化合物,用电子式表示该化合物:___________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键,则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是_________,为共价化合物的是__________________________。