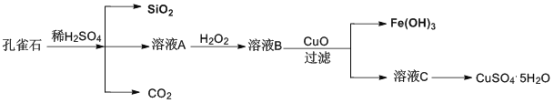题目内容
【题目】今有一混合物水溶液,可能含有以下离子中的若干种:Na+、Ba2+、Cl﹣、CO32﹣、SO42﹣,现取200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推断不正确的是
A.溶液中一定存在CO32﹣、SO42﹣、Na+B.溶液中c(Na+)≥0.6mol·L-1
C.溶液中一定没有Ba2+,可能存在Cl﹣D.溶液中n(SO42﹣)>0.02mol
【答案】D
【解析】
200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。此信息告诉我们,m(BaSO4)= 4.66g,m(BaCO3)= 12.54g-4.66g=7.88g。
从分析中我们可以得出:n(BaSO4)=![]() ,
,
n(BaCO3)=![]() ,从而得出n(SO42-)=0.02mol,n(CO32-)=0.04mol。
,从而得出n(SO42-)=0.02mol,n(CO32-)=0.04mol。
依据离子共存原则,溶液中一定不含有Ba2+;依据电荷守恒原则,溶液中一定含有Na+,
但不能肯定Cl-是否存在。从而得出n(Na+)≥2n(SO42-)+2n(CO32-)=0.12mol,
cNa+)≥![]() ,
,
A. 溶液中一定存在CO32﹣、SO42﹣、Na+,正确;
B. 溶液中c(Na+)≥0.6mol·L-1,正确;
C. 溶液中一定没有Ba2+,可能存在Cl-,正确;
D. 溶液中n(SO42﹣)>0.02mol,错误。
故选D。

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
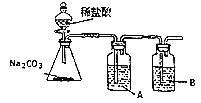
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。