题目内容
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的NH4+:试液![]() 气体
气体![]() 试纸变蓝
试纸变蓝
C.检验试液中的I-:试液![]() 黄色溶液
黄色溶液![]() 深黄色溶液
深黄色溶液
D.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
【答案】B
【解析】
A. 检验试液中的SO42-:试液中若含有亚硫酸根离子可被硝酸氧化为硫酸根,不能检验硫酸根离子,故A错误;
B. 检验试液中的NH4+:试液加入氢氧化钠产生气体,该气体为氨气,湿润的红色石蕊试纸遇氨气变蓝,说明含有NH4+,故B正确;
C. 检验试液中的I-:若含有碘离子,加入双氧水应生成碘单质,碘单质遇淀粉变蓝,故C错误;
D. 检验试液中的Fe2+:试液先加硫氰化钾溶液无现象,再加入氯水变为红色溶液,说明试液中含有Fe2+,故D错误;
答案选B。

【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
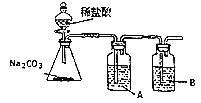
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。
【题目】下表给出了14种元素的电负性:
元素 | 电负性 | 元素 | 电负性 | 元素 | 电负性 |
Al | 1.5 | B | 2.0 | Be | 1.5 |
C | 2.5 | Cl | 3.0 | F | 4.0 |
Li | 1.0 | Mg | 1.2 | N | 3.0 |
Na | 0.9 | O | 3.5 | P | 2.1 |
Cl | 2.5 | S | 1.8 |
(1)同一周期中,从左到右,主族元素的电负性_________;同一主族中,从上到下,元素的电负性_________。主族元素的电负性随原子序数递增呈_________变化。
(2)短周期元素中,电负性最大的元素与电负性最小的元素形成的化合物属于____________化合物,用电子式表示该化合物:___________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键,则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是_________,为共价化合物的是__________________________。
【题目】(一)现有浓度均为![]() 的盐酸、硫酸、醋酸三种溶液,回答下列问题:
的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中![]() 分别为
分别为![]() ,则它们的大小关系为_________________________________________。
,则它们的大小关系为_________________________________________。
(2)等体积的以上三种酸分别与过量的![]() 溶液反应,若生成的盐的物质的量依次为
溶液反应,若生成的盐的物质的量依次为![]() ,则它们的大小关系为__________________________。
,则它们的大小关系为__________________________。
(3)分别用以上三种酸中和一定量的![]() 溶液生成正盐,若需要酸的体积分别为
溶液生成正盐,若需要酸的体积分别为![]() ,其大小关系为__________________________________。
,其大小关系为__________________________________。
(4)分别与锌反应,开始时生成氢气的速率为![]() ,其大小关系为______________________。
,其大小关系为______________________。
(二)有![]() 四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 |
|
阴离子 |
|
已知:①![]() 溶液的
溶液的![]() 均大于7,
均大于7, ![]() 的溶液中水的电离程度相同;②
的溶液中水的电离程度相同;②![]() 溶液和
溶液和![]() 溶液相遇时只生成白色沉淀,
溶液相遇时只生成白色沉淀, ![]() 溶液和
溶液和![]() 溶液相遇时只生成刺激性气味的气体,
溶液相遇时只生成刺激性气味的气体, ![]() 溶液和
溶液和![]() 溶液混合时无现象。
溶液混合时无现象。
(1) ![]() 是_________________________,
是_________________________,![]() 是_______________________(填化学式)。
是_______________________(填化学式)。
(2)写出![]() 和
和![]() 反应的离子方程式_________________________________。
反应的离子方程式_________________________________。
(3) ![]() 时,
时, ![]() 溶液的
溶液的![]() ,则
,则![]() 溶液中
溶液中![]() _________________________________________(用含有
_________________________________________(用含有![]() 的关系式表示)。
的关系式表示)。
(4)将等体积、等物质的量浓度的![]() 溶液和
溶液和![]() 溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________。
溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________。
(5)在一定体积的![]() 的
的![]() 溶液中,加入一定体积的
溶液中,加入一定体积的![]() 的盐酸,混合溶液的
的盐酸,混合溶液的![]() ,若反应后溶液的体积等于
,若反应后溶液的体积等于![]() 溶液与盐酸的体积之和,则
溶液与盐酸的体积之和,则![]() 溶液与盐酸的体积比是_______________。
溶液与盐酸的体积比是_______________。