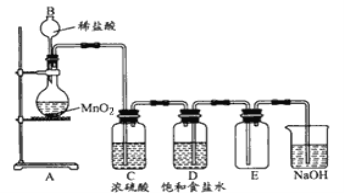
题目内容
【题目】《必修1》中学习过:A过滤、B蒸发(结晶)、C蒸馏、D分液、E萃取、F配制一定物质的量浓度的溶液,根据所学的知识回答下列下列问题:
(1)选用适当的方法分离或提纯,应选用上述哪一种?(填序号)
①除去 NaCl 溶液中所含的少量 KNO3__________;
②从碘水中提取碘__________;
③用自来水制取蒸馏水__________;
④分离植物油和水__________;
(2)除过滤、蒸发(结晶)外还有_____实验用到了玻璃棒。需要加热的实验有蒸发(结晶)和__________;填序号)。
(3)图是硫酸试剂瓶标签上的内容。实验室用该硫酸配制240mL0.46mol/L的稀硫酸,则

a.需量取该硫酸的体积为__________mL;
b.有以下仪器:①烧杯 ②100mL量筒 ③250mL容量瓶④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦10mL量筒⑧胶头滴管,配制过程中,必须使用的仪器是_____(填代号);
(4)该同学实际配制得到的浓度为0.47mol/L,可能的原因是_______________
A.量取浓H2SO4时仰视刻度 B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶 D.定容时仰视刻度
【答案】B E C D F C 6.3 ①③⑤⑦⑧ A
【解析】
(1)①硝酸钾和氯化钠的溶解度受温度影响不同;
②碘不易溶于水,易溶于有机溶剂;
③水易挥发和冷凝;
④植物油和水互不相溶;
(2)除过滤、蒸发(结晶)外还有配制一定物质的量浓度的溶液实验用到了玻璃棒,蒸发、蒸馏实验需要加热;
(3)a.根据c=![]() 计算浓硫酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
计算浓硫酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
b.依据配制一定物质的量浓度溶液时的一般步骤选择需要仪器;
(4)根据c=![]() 进行误差分析,凡是引起n偏小或者V偏大的操作,所配溶液的浓度将会偏小;凡是引起n偏大或者V偏小的操作,所配溶液的浓度将会偏大。
进行误差分析,凡是引起n偏小或者V偏大的操作,所配溶液的浓度将会偏小;凡是引起n偏大或者V偏小的操作,所配溶液的浓度将会偏大。
(1)①硝酸钾和氯化钠的溶解度受温度影响不同,可重结晶的方法分离,故答案为:B;
②碘不易溶于水,易溶于有机溶剂,则从碘水中提取碘单质采取萃取分液法分离,故答案为:E;
③自来水中含有一些难以挥发的无机盐类物质,可通过蒸馏的方法制取蒸馏水,故答案为:C;
④植物油和水互不相溶,可用分液的方法分离,故答案为:D;
(2)过滤、配制溶液需要玻璃棒引流,蒸发需要玻璃棒搅拌,则ABE中使用玻璃棒;蒸发、蒸馏实验需要加热,则BC需要加热;故答案为:F;C;
(3)a.浓H2SO4的物质的量浓度c=![]() mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,配制240mL溶液需要选择250mL容量瓶,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×0.46mol/L,解得:x≈6.3mL;
mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,配制240mL溶液需要选择250mL容量瓶,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×0.46mol/L,解得:x≈6.3mL;
b.配制一定物质的量浓度溶液时的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,用到的仪器:量筒、玻璃棒、烧杯、胶头滴管、250mL容量瓶,量取6.3mL浓硫酸需要选择10mL量筒,故选:①③⑤⑦⑧;
(4)A.量取浓H2SO4时仰视刻度,导致量取的浓硫酸的体积偏大,硫酸的物质的量偏大,浓度偏高,故A正确;
B.容量瓶洗净后未经干燥处理,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B错误;
C.没有将洗涤液转入容量瓶,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故C错误;
D.定容时仰视刻度,导致溶液体积偏大,溶液浓度偏低,故D错误;
故答案为A。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
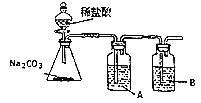
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。