题目内容
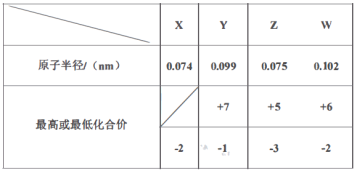
【题目】A、B、C、D、E五种短周期主族元素,前三种元素在周期表中的位置如图所示:
A、B、C三种元素中有两种元素的最高价氧化物对应的水化物是强酸,D元素的原子半径在短周期元素中最大,E是最高正价为![]() 的非金属元素。
的非金属元素。
(1)C在周期表中的位置是______
(2)A、B、C三种元素中两种元素所形成的两种强酸的分子式分别为______;上述五种元素形成的简单离子中,电子层结构相同的离子的半径由大到小的顺序为____________
(3)举例说明C的非金属性比B的非金属性强:____________
(4)D的单质与E所形成的最常见化合物能发生剧烈反应,写出相应的离子方程式:____________;A、E之间形成的最简单化合物(过量)与C的单质混合后可得到一种单质和一种盐,对应的化学方程式为____________
【答案】第二周期ⅦA族 ![]() 、
、![]()
![]() HF比H2S稳定(其他合理答案也可)
HF比H2S稳定(其他合理答案也可) ![]()
![]()
【解析】
对照A、B、C在周期表中的位置图,结合“A、B、C三种元素中有两种元素的最高价氧化物对应的水化物是强酸”,可推出A为氮、B为硫、C为氟。由“D元素的原子半径在短周期元素中最大”,可确定D为钠;由“E是最高正价为![]() 的非金属元素”,可确定E为氢。
的非金属元素”,可确定E为氢。
(1)由上面分析可知,C为氟,在周期表中的位置是第二周期ⅦA族。答案为:第二周期ⅦA族;
(2)A、B、C三种元素中,N、S两种元素所形成的两种强酸的分子式分别为HNO3、H2SO4;上述五种元素形成的简单离子中,电子层结构相同的离子为N3-、F-、Na+,依据“核电荷数越大,离子半径越小”的规律,半径由大到小的顺序为![]() 。答案为:HNO3、H2SO4;
。答案为:HNO3、H2SO4;![]() ;
;
(3)比较F和S的非金属性,可比较其氢化物的稳定性,从而得出证明C的非金属性比B的非金属性强的例子:HF比H2S稳定。答案为:HF比H2S稳定(其他合理答案也可);
(4)Na可与H2O发生剧烈反应,相应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;A、E之间形成的最简单化合物NH3(过量)与C的单质F2混合后,可得到一种单质N2和一种盐NH4F,对应的化学方程式为8NH3+3F2=N2+6NH4F。答案为:2Na+2H2O=2Na++2OH-+H2↑;8NH3+3F2=N2+6NH4F。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案