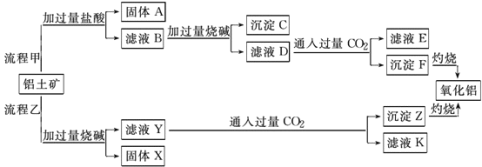
题目内容
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 与
与![]() 、
、![]() 与
与![]() 分别位于同一主族,
分别位于同一主族,![]() 与
与![]() 可形成共价化合物
可形成共价化合物![]() ,
,![]() 原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A.![]() 分子中的所有原子最外层都为8电子结构
分子中的所有原子最外层都为8电子结构
B.![]() 、
、![]() 的化学键类型相同
的化学键类型相同
C.![]() 是共价化合物
是共价化合物
D.原子半径:![]()
【答案】D
【解析】
![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 原子的内层电子总数是其最外层电子数的2.5倍,则
原子的内层电子总数是其最外层电子数的2.5倍,则![]() 有3个电子层,价电子数为
有3个电子层,价电子数为![]() ,故
,故![]() 为
为![]() ;
;![]() 与
与![]() 位于同一主族,所以
位于同一主族,所以![]() 为
为![]() ;
;![]() 与
与![]() 可形成共价化合物
可形成共价化合物![]() ,则
,则![]() 为
为![]() ;
;![]() 与
与![]() 位于同一主族,所以
位于同一主族,所以![]() 为
为![]() 。
。
A项,由![]() 的电子式可知
的电子式可知![]() 分子中所有原子最外层都为8电子结构,A项正确;
分子中所有原子最外层都为8电子结构,A项正确;
B项,![]() 、
、![]() 中均只含有共价键,B项正确;
中均只含有共价键,B项正确;
C项,![]() 是共价化合物,C项正确;
是共价化合物,C项正确;
D项,电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小,故原子半径的大小顺序为![]() ,D项错误。
,D项错误。
答案为D。

【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1
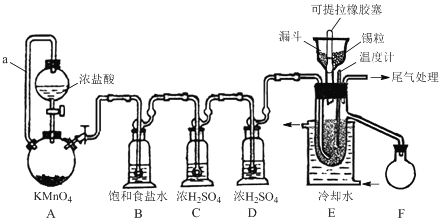
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。
(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
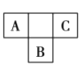
【题目】(1)填写表中空格:
符号 | 质子数 | 电子数 |
___ | 1 | 0 |
| ___ | ___ |
| ___ | b |
(2)元素周期表中第五周期共有___种元素,若第五周期ⅤA族元素的原子序数为![]() ,则第五周期ⅡA族元素的原子序数为___(用含
,则第五周期ⅡA族元素的原子序数为___(用含![]() 的代数式表示,下同),第六周期ⅤA族元素的原子序数为____。
的代数式表示,下同),第六周期ⅤA族元素的原子序数为____。
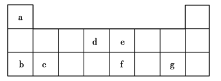
(3)紧邻第Ⅷ族之后的一个纵行为第____族,元素周期表中所含元素种数最多的族是第___族。
(4)某元素的一种同位素![]() 的原子的质量数为
的原子的质量数为![]() ,含
,含![]() 个中子,它与
个中子,它与![]() 原子组成
原子组成![]() 分子,则
分子,则![]()
![]()
![]() 中所含质子的物质的量是___
中所含质子的物质的量是___![]() 。
。