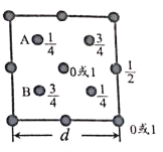
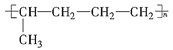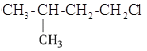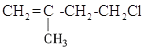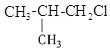题目内容
【题目】化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种。
①海水中镁的总储量约为1.8×1015t,海水里镁的存在形式是__(填“游离态”或“化合态”)。
②氯碱工业是重要的化学工业之一,写出该反应原理的离子方程式:__。
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①铁和铝是两种常见的金属材料,在空气中铝比铁耐腐蚀的原因是__。
②新型陶瓷氮化铝可用氧化铝高温还原法制备,化学方程式如下,请配平该化学反应方程式并标出电子转移方向和数目。_________
Al2O3+C+N2![]() AlN+CO
AlN+CO
(3)保持洁净安全的生存环境已成为全人类的共识。二氧化硫是引起酸雨的一种主要物质,必须严格控制排放。
①写出二氧化硫与足量NaOH溶液反应的离子方程式:__。
②酸雨降落到地面后,其中的亚硫酸在空气中被氧气逐渐氧化生成硫酸,使酸性进一步增强。写出这一过程的化学方程式:__。
【答案】化合态 2Cl-+2H2O![]() 2OH-+H2 ↑+Cl2↑ 铝在空气中表面易形成氧化膜,,可以保护铝不会进一步被腐蚀
2OH-+H2 ↑+Cl2↑ 铝在空气中表面易形成氧化膜,,可以保护铝不会进一步被腐蚀 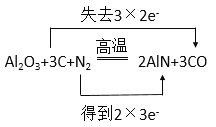 SO2+2OH-= SO32-+H2O 2H2SO3+O2=2H2SO4
SO2+2OH-= SO32-+H2O 2H2SO3+O2=2H2SO4
【解析】
⑴①海水里镁的存在形式是化合态;
②氯碱工业是电解饱和食盐水。
⑵①在空气中铝比铁耐腐蚀的原因是铝在空气中表面易形成氧化膜,可以保护铝不会进一步被腐蚀;
②新型陶瓷氮化铝可用氧化铝高温还原法制备,碳化合价升高2个,氮气化合价降低6个,根据得失电子守恒,配平并标出电子转移方向和数目;
⑶①二氧化硫与足量NaOH溶液反应生成亚硫酸根和水;
②酸雨降落到地面后,其中的亚硫酸在空气中被氧气逐渐氧化生成硫酸。
⑴①海水里镁的存在形式是化合态;
②氯碱工业是重要的化学工业之一,该反应原理的离子方程式:2Cl-+2H2O![]() 2OH-+H2 ↑+Cl2↑;
2OH-+H2 ↑+Cl2↑;
⑵①铁和铝是两种常见的金属材料,在空气中铝比铁耐腐蚀的原因是铝在空气中表面易形成氧化膜,可以保护铝不会进一步被腐蚀;
②该反应的电子转移方程式为: ;
;
⑶①二氧化硫与足量NaOH溶液反应生成亚硫酸根和水,其离子方程式:SO2 +2OH-=SO32-+H2O;
②酸雨降落到地面后,其中的亚硫酸在空气中被氧气逐渐氧化生成硫酸,使酸性进一步增强,这一过程的化学方程式:2H2SO3+O2=2H2SO4。

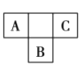
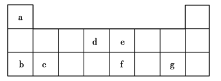
【题目】(1)填写表中空格:
符号 | 质子数 | 电子数 |
___ | 1 | 0 |
| ___ | ___ |
| ___ | b |
(2)元素周期表中第五周期共有___种元素,若第五周期ⅤA族元素的原子序数为![]() ,则第五周期ⅡA族元素的原子序数为___(用含
,则第五周期ⅡA族元素的原子序数为___(用含![]() 的代数式表示,下同),第六周期ⅤA族元素的原子序数为____。
的代数式表示,下同),第六周期ⅤA族元素的原子序数为____。
(3)紧邻第Ⅷ族之后的一个纵行为第____族,元素周期表中所含元素种数最多的族是第___族。
(4)某元素的一种同位素![]() 的原子的质量数为
的原子的质量数为![]() ,含
,含![]() 个中子,它与
个中子,它与![]() 原子组成
原子组成![]() 分子,则
分子,则![]()
![]()
![]() 中所含质子的物质的量是___
中所含质子的物质的量是___![]() 。
。