题目内容
17. 铜、锰及其合金是人类常用的金属材料.
铜、锰及其合金是人类常用的金属材料.(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4.
①写出基态Mn原子的价电子排布式为3d54s2.
②CO32-的空间构型是平面三角形(用文字描述).
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O.
①根据等电子体原理,CO分子的结构式为C≡O.
②CO2分子中C原子轨道的杂化类型为sp.
③1 mol甲醛(HCHO)分子中所含σ键的数目为3×6.02×1023.
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图:
①胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4•H2O.
②胆矾中SO42-的空间构型为正四面体,H2O中O原子的杂化类型为sp3杂化.
分析 (1)①Mn原子核外电子数为25,根据能量最低原理可书写Mn的基态原子的价电子排布式;
②计算C原子价层电子对数、孤电子对数,进而确定其空间构型;
(2)①原子数目和价电子总数相同微粒互为等电子体,CO与N2互为等电子体,二者结构相似,CO分子中原子之间形成三键;
②CO2的结构式为O=C=O,根据σ键数目判断;
③甲醛的结构式为 ,单键为σ键,双键含有1个σ键、1个π键;
,单键为σ键,双键含有1个σ键、1个π键;
(3)①Cu2+提供空轨道,水中氧原子提供孤对电子,Cu2+与4个水分子之间形成配位键,另外的水分子、硫酸根及配离子通过氢键结合;
②计算SO42-中S原子价层电子对数、孤电子对数确定空间构型,H2O中O原子形成2个σ键,含有2对孤电子对,杂化轨道数目为4.
解答 解:(1)①Mn原子核外电子数为25,基态原子的电子排布式为:1s22s22p63s23p63d54s2,价电子电子排布式可为3d54s2,
故答案为:3d54s2;
②CO32-中C原子价层电子对数为3+$\frac{4+2-2×3}{2}$=4、没有孤对电子,其空间构型为平面三角形,
故答案为:平面三角形;
(2)①CO与N2互为等电子体,二者结构相似,CO分子中原子之间形成三键,故其结构式为C≡O,
故答案为:C≡O;
②CO2的结构式为O=C=O,C原子形成2个σ键,没有孤对电子,杂化轨道数目为2,采取sp杂化,
故答案为:sp;
③甲醛的结构式为 ,单键为σ键,双键含有1个σ键、1个π键,分子含有3个σ键,1 mol甲醛(HCHO)分子中所含σ键的数目为3×6.02×1023,
,单键为σ键,双键含有1个σ键、1个π键,分子含有3个σ键,1 mol甲醛(HCHO)分子中所含σ键的数目为3×6.02×1023,
故答案为:3×6.02×1023;
(3)①Cu2+提供空轨道,水中氧原子提供孤对电子,Cu2+与4个水分子之间形成配位键,另外的水分子、硫酸根及配离子通过氢键结合,胆矾的化学式用配合物的形式表示为:[Cu(H2O)4]SO4•H2O,
故答案为:[Cu(H2O)4]SO4•H2O;
②SO42-中S原子价层电子对数为4+$\frac{6+2-2×4}{2}$=4、没有孤电子对,其空间构型为正四面体,H2O中O原子形成2个σ键,含有2对孤电子对,杂化轨道数目为4,O原子采取sp3杂化,
故答案为:正四面体;sp3杂化.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、空间构型、等电子体、化学键、配合物等,注意对基础知识的理解掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  制取少量H2 | |
| B. |  分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. |  验证Na和水反应为放热效应 | |
| D. |  收集氨气 |
| A. | 5.6g金属铁于足量的盐酸反应,转移电子数为0.2NA | |
| B. | 标准状况下,以任意比混合的H2、CO2的混合气体22.4L,所含分子数为NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,溶质的物质的量浓度为1mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
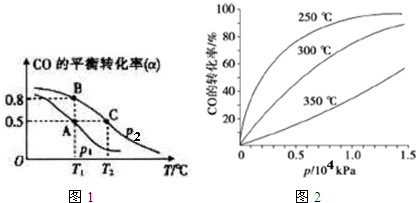
 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).(1)图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H>0(填“>”“=”或“<”).
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远.50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol•L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42-的沉淀率为60%,计算实验测得的平衡常数.
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42-的沉淀率.
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加人Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1molKOH的溶液与lmolCO2完全反应后,溶液中c(K+ )=c (HCO3- ) | |
| D. | 改变条件使醋酸溶液中的醋酸根离子浓度增大,溶液的pH值可能减小也可能增大 |

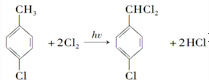 ;该反应的类型为取代反应.
;该反应的类型为取代反应. .
.