题目内容
7.煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
又已知:H2O(l)═H2O(g)△H2 CO(g)+H2O(g)?CO2(g)+H2(g)△H3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H
则:△H与△H1、△H2、△H3之间的关系是:△H=△H1-3△H2-2△H3.
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有BD.
A.v(H2)=2v(CO)
B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量不随时间而变化
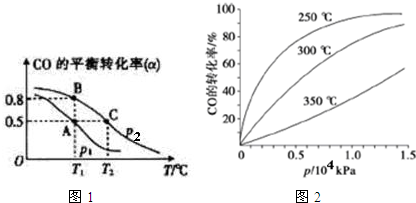
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g) CH3OH(g),在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示.
①合成甲醇的反应为放热(填“放热”或“吸热”)反应.
②A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC.P1和P2的大小关系为P1<P2.
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为2L.
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如图2所示,实际生产时条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104Pa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,生产成本却增加.
分析 (1)①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(l)?H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根据盖斯定律,方程式①-3×②-2×③得到方程2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l),据此计算△H;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动;
②平衡常数与浓度、压强无关,只与温度有关,结合平衡移动判断;增大压强平衡正移,CO的转化率增大;
③A、B两点温度相等,压强不同,平衡常数相同,利用三段式计算A、B两点平衡时各组分物质的量,根据A点各物质的浓度计算平衡常数,再根据平衡常数计算B点体积;
④由图3可知,在250°C、1.3x104kPa左右,时CO的转化率已较高,再增大压强CO转化率提高不大,且增大成本.
解答 解:(1)已知:①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(1)═H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根据盖斯定律,则①-②×3-③×2得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,
故答案为:H=△H1-3△H2-2△H3;
(2)A.2v(H2)=v (CO)中未指明正逆速率,不能说明得到平衡,故A错误;
B.平衡常数与浓度、压强无关,只与温度有关,温度一定时平衡常数为定值,绝热密闭容器中,容器中的温度随着反应进行不断变化,则平衡常数不断变化,当平衡常数不变时说明达到了平衡状态,故B正确;
C.容器体积不变,混合气体总质量不变,混合气体密度始终保持不变,不能说明得到平衡,故C错误;
D.混合气体总质量不变,随反应进行气体物质的量减小,混合气体平均相对分子质量减小,当混合气体的平均相对分子质量不随时间而变化,说明反应到达平衡,故D正确,
故答案为:BD;
(3)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则KA=KB,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故KB>KC,故KA=KB>KC;增大压强平衡正移,CO的转化率增大,已知P2条件下,CO的转化率大,则P1<P2;
故答案为:KA=KB>KC; P1<P2;
③A、B两点温度相等,压强不同,平衡常数相同,
对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K=$\frac{\frac{5}{10}}{\frac{5}{10}×(\frac{10}{10})^{2}}$=1
对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得V=2
故答案为:2.
④由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,
故答案为:在1.3×104Pa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,生产成本却增加.
点评 本题考查化学平衡常数有关计算、化学平衡图象及影响因素、化学平衡状态判断、反应热计算,注意掌握化学平衡常数的应用,掌握三段式计算方法,难度中等.

| A. | 一氯代烷烃,随C原子数的增多,密度依次增大 | |
| B. | 常温下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 饱和一元羧酸,随C原子数的增多,酸性逐渐减弱 | |
| D. | 邻-二甲苯、间-二甲苯,对-二甲苯的沸点依次升高 |
| A. | 3.0 L 0.1 mol•L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则原醋酸溶液醋酸的电离度为1% | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx 汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
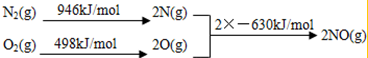
则N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
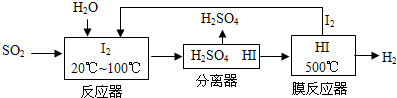
①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式H2-2e-+2OH-=2H2O
(4)为了改善环境,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C(填序号).
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑B.高温使水分解制氢:2H2O(g)$\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳能}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=0.125mol•L-1•min-1.
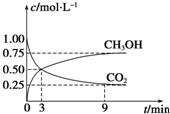
③能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
④工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
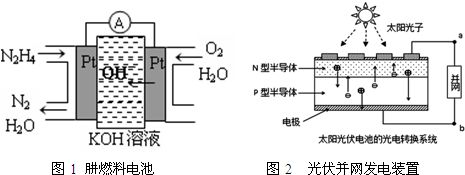
| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子材料 | |
| B. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅是硅单质,光导纤维的主要成分是二氧化硅 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化、杀菌消毒 |
| A. | 为防止食品氧化变质,食品袋中放有硅胶包 | |
| B. | 酒精用来杀菌消毒,利用了乙醇的氧化性 | |
| C. | 植物油与矿物油可以通过水解反应区分 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
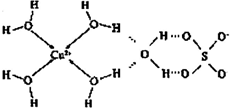 铜、锰及其合金是人类常用的金属材料.
铜、锰及其合金是人类常用的金属材料.