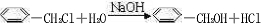题目内容
7. 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)SO42ˉ的立体构型是正四面体结构,其中S原子的杂化轨道类型是SP3.
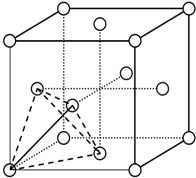
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为5d106s1.一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为3:1,该晶体中,原子之间的作用力是金属键键合力.
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如图),该晶体储氢后的化学式应为Cu3AuH8;假设在另一条件下,氢原子可进入到由Cu原子与Au原子构成的八面体空隙中心,该晶体储氢后的化学式为Cu3AuH4.(提示:查找四面体、八面体时,需假设Cu原子与Au原子等同;每个四面体、八面体内只填充一个氢原子)
分析 (1)Cu和浓硫酸在加热条件下反应生成二氧化硫和硫酸铜;
(2)根据价层电子对互斥模型判断;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,以此判断电子排布式,利用均摊法计算晶胞;
(4)利用均摊法计算.
解答 解:(1)Cu和浓硫酸在加热条件下反应生成二氧化硫和硫酸铜,
反应的方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)硫酸根中心原子的价层电子对为:孤对电子数$\frac{6+2-2×4}{2}$=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;
故答案为:正四面体结构;SP3;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则Au原子外围电子排布式为5d106s1,在晶胞中Cu原子处于面心,N(Cu)=6×$\frac{1}{2}$=3,Au原子处于顶点位置,N(Au)=8×$\frac{1}{8}$=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键键合力,
故答案为:5d106s1;3:1;金属键键合力;
(4)氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,氢原子可进入到由Cu原子与Au原子构成的八面体空隙中心,则H原子应位于晶胞内部,则应含有4个H,则化学式为Cu3AuH4,
故答案为:Cu3AuH8;Cu3AuH4;
点评 本题侧重于考查非极性分子的判断、硫酸铜的制备方程式、水的检验方法、杂化轨道理论和立体构型、元素周期律的应用、元素的核外电子排布式等知识,题目难度中等,答题时注意根据信息得出合理推论.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 | |
| B. | 12g金刚石中,含C-C共价键键数为4mol | |
| C. | 水晶、干冰熔化时克服粒子间作用力的类型相同 | |
| D. | 熔点由高到低的顺序是:晶体硅>碳化硅>金刚石 |
| A. | 加水,使溶液体积变为原来的10倍 | B. | 升高温度(不考虑NH3的挥发) | ||
| C. | 加入适量的NH4Cl固体 | D. | 加入等体积0.2mol/L的氢氧化钠 |
| A. | Na2CO3和NaHCO3 | B. | Na和Mg | C. | KHCO3和K2CO3 | D. | Si和Al |
①蛋白质 ②氨基酸 ③油脂 ④淀粉 ⑤乙烷 ⑥纤维素 ⑦聚乙烯.
| A. | 只有①⑦ | B. | 除②外都是 | C. | 只有①④⑥⑦ | D. | 只有①③ |
| A. | 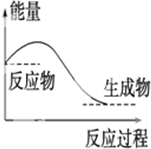 对于如图所示的过程,是放出能量的过程 | |
| B. | 由“C(石墨)=C(金刚石)”反应为吸热,可知,金刚石比石墨稳定 | |
| C. | 由水变成冰是放热反应 | |
| D. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
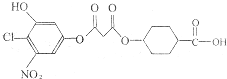 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )| A. | 既可以催化加氢,又可以使酸性高锰酸钾溶液褪色 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 | |
| C. | 1mol该化合物最多可以与7molNaOH反应 | |
| D. | 可以与Br2的CCl4溶液发生加成反应,但不可以在光照下与Br2发生取代反应 |
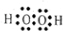 .
.
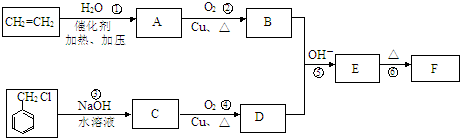
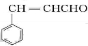 .E中含氧官能团的名称为羟基、醛基.
.E中含氧官能团的名称为羟基、醛基.