题目内容
16.下列说法中正确的是( )| A. | 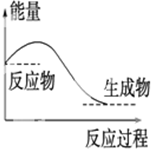 对于如图所示的过程,是放出能量的过程 | |
| B. | 由“C(石墨)=C(金刚石)”反应为吸热,可知,金刚石比石墨稳定 | |
| C. | 由水变成冰是放热反应 | |
| D. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
分析 A.根据放热反应中反应物的总能量大于生成物的总能量;
B.物质能量高的不稳定;
C.水变成冰是物理变化;
D.中和热的本质是在稀溶液中,1mol氢离子与1mol氢氧根反应,生成1mol水放出的热量.
解答 解:A.反应物的总能量大于生成物的总能量,该反应为放热反应,故A正确;
B.由C(石墨)=C(金刚石)反应为吸热,可知金刚石的能量比石墨的能量高,所以石墨比金刚石稳定,故B错误;
C.水变成冰是物理变化,不是化学反应,故C错误;
D.生成水的物质的量不是1mol,且有钡离子与硫酸根反应生成硫酸钡沉淀,也有热量放出,故D错误.
故选A.
点评 本题考查热反应热、中和热,难度不大,注意中和热必须是酸和碱的稀溶液,1mol氢离子与1mol氢氧根反应,生成1mol水.

练习册系列答案
相关题目
6.下列叙述肯定正确的是( )
| A. | 在离子晶体中不可能存在非极性键 | |
| B. | 在共价化合物的分子晶体中不可能存在离子键 | |
| C. | 在极性分子中不可能存在非极性键 | |
| D. | 在原子晶体中不可能存在极性共价键 |
4.下列溶液中,物质的量浓度最大的是( )
| A. | 1L浓H2SO4中含有0.5gH2SO4 | B. | 0.5L含有49gH2SO4的溶液 | ||
| C. | 0.5gH2SO4溶于水配成2L溶液 | D. | 0.1L含24.5gH2SO4的溶液 |
11.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 常温常压下,2g氦气所含原子数是0.5NA | |
| B. | 常温常压下,11.2L氯气所含分子数是0.5NA | |
| C. | 同温同压下,密度相同的两种气体的摩尔质量相同 | |
| D. | 同温同压下,原子数都是NA的两种气体的体积相同 |
8.下列关于Na和Na+性质的叙述正确的是( )
| A. | 它们都显碱性 | B. | 它们都有强还原性 | ||
| C. | 它们都能跟H2O、O2反应 | D. | Na只有还原性,Na+只有氧化性 |
5.外围电子构型为3d104s1的元素R( )
| A. | 位于第四周期第IA族 | |
| B. | 能形成稳定的R2+离子 | |
| C. | 在化学反应中,首先失去3d上的电子 | |
| D. | 原子序数为28 |
6.下列溶液中通入SO2无明显现象的是( )
| A. | Ba(OH)2 | B. | Ba(NO3)2 | C. | 溴水 | D. | BaCl2 |
 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题: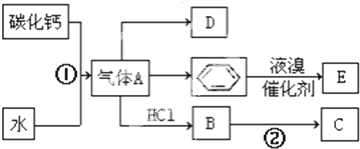
 ;D的结构简式CH2=CH2;
;D的结构简式CH2=CH2;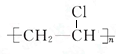 ;反应类型加聚反应;
;反应类型加聚反应; +Br2 $\stackrel{催化剂}{→}$
+Br2 $\stackrel{催化剂}{→}$ +HBr;反应类型取代反应.
+HBr;反应类型取代反应.