题目内容
2.下列各组物质中,都能与盐酸反应放出气体,并且后者与盐酸反应比前者与盐酸反应放出气体更迅速的是(溶液的浓度均相同)( )| A. | Na2CO3和NaHCO3 | B. | Na和Mg | C. | KHCO3和K2CO3 | D. | Si和Al |
分析 A、酸的酸式盐阴离子只需结合一个H+生成CO2和H2O,而其正盐需结合两个H+生成CO2和H2O,所以反应放出气体后者比前者缓慢;
B、金属越活泼(还原性越强)与酸反应越剧烈;
C、酸的酸式盐阴离子只需结合一个H+生成CO2和H2O,而其正盐需结合两个H+生成CO2和H2O,所以反应放出气体后者比前者缓慢;
D、Si不与盐酸反应;
解答 解:A、酸的酸式盐阴离子只需结合一个H+生成CO2和H2O,而其正盐需结合两个H+生成CO2和H2O,所以NaHCO3 反应放出气体比Na2CO3反应快,后者快,故A正确;
B、金属越活泼(还原性越强)与酸反应越剧烈,Na和Mg是钠反应剧烈,前者快,故B错误;
C、分析可知KHCO3反应速率比K2CO3 反应速率快,故C错误;
D、Si不与盐酸反应,Al和盐酸反应,故D错误;
故选A.
点评 本题考查了金属反应,盐类反应的速率分析,主要是反应实质的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
13.PH3(膦)分子空间构型是三角锥形,以下关于PH3的叙述中,正确的是( )
| A. | PH3是非极性分子 | B. | PH3分子中的P-H 键是非极性键 | ||
| C. | PH3中心原子杂化轨道类型为sp2型 | D. | PH3分子中有未成键的电子对 |
10.在强酸性溶液中一定能大量共存的离子组是( )
| A. | OH-、Na+、K+、HCO3- | B. | Na+、K+、Cl-、Ag+ | ||
| C. | Mg+、SO42-、Na+、NO3- | D. | MnO4-、Fe2+、CO32-、Ba2+ |
17.A、B、C、D、E是元素周期表前四周期中的五种常见元素,其相关信息如下表:
请回答下列问题
(1)C元素原子的价电子排布图是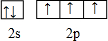
(2)E元素位于周期表ds区,E+离子的核外电子排布式是1s22s22p63s23p63d10
(3)CA3极易溶于水的主要原因是NH3与H2O分子间形成氢键C3-离子的中心原子采用sp杂化,C3-离子的空间构型是直线型
(4)A、C、E三种元素可形成〔E(CA3)4〕2+配离子,其中存在的化学键类型有①③(填序号,①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键)
(5)〔E(CA3)4〕2+可由E的硫酸盐溶液中通入过量CA3气体得到,写出该配离子的结构简式 .
.
| 元素 | 相关信息 |
| A | A原子的1S轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2P轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(1)C元素原子的价电子排布图是

(2)E元素位于周期表ds区,E+离子的核外电子排布式是1s22s22p63s23p63d10
(3)CA3极易溶于水的主要原因是NH3与H2O分子间形成氢键C3-离子的中心原子采用sp杂化,C3-离子的空间构型是直线型
(4)A、C、E三种元素可形成〔E(CA3)4〕2+配离子,其中存在的化学键类型有①③(填序号,①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键)
(5)〔E(CA3)4〕2+可由E的硫酸盐溶液中通入过量CA3气体得到,写出该配离子的结构简式
 .
.
14.下列离子方程式属于盐的水解,且书写正确的是( )
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| D. | Cl2溶于H2O中:Cl2+H2O═H++Cl-+HClO |
11.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 常温常压下,2g氦气所含原子数是0.5NA | |
| B. | 常温常压下,11.2L氯气所含分子数是0.5NA | |
| C. | 同温同压下,密度相同的两种气体的摩尔质量相同 | |
| D. | 同温同压下,原子数都是NA的两种气体的体积相同 |
 ,
,
 +2H2O.
+2H2O. 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题: 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: