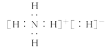题目内容
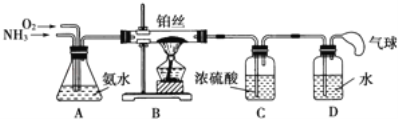
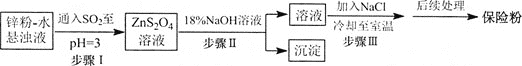
【题目】ZnSe是一种光电性能优异的半导体材料,某研究小组用如图1方法制备了ZnSe.

![]() 溶于水生成
溶于水生成![]() ,下列物质与水反应,跟此反应类型相同的是 ______
,下列物质与水反应,跟此反应类型相同的是 ______
![]()
![]()
![]()
![]()
![]()
![]() 硒酸
硒酸![]() 的水溶液按下式发生一级和二级电离:
的水溶液按下式发生一级和二级电离:![]() ;
;![]() ,
,![]()
![]() 溶液显 ______
溶液显 ______ ![]() 填“酸性”、“中性”、“碱性”
填“酸性”、“中性”、“碱性”![]() .
.
![]() 向
向![]() 溶液中滴加少量氨水,该反应的离子方程式为 ______ .
溶液中滴加少量氨水,该反应的离子方程式为 ______ .
![]() 已知
已知![]() 的两级电离常数分别为
的两级电离常数分别为![]() ,
,![]() ,则
,则![]() 和
和![]() 两溶液混合后反应的离子方程式为 ______ .
两溶液混合后反应的离子方程式为 ______ .
![]() 肼
肼![]() 与
与![]() 反应的氧化产物是
反应的氧化产物是![]() 氧化剂与还原剂的物质的量之比为 ______ .
氧化剂与还原剂的物质的量之比为 ______ .
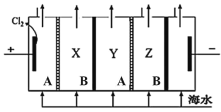
![]() 电化学降解法可用于治理水中硝酸盐的污染,所得产物可直接排入大气.其原理如图2所示,其中B为电源的 ______ 极,乙池中电极反应式为 ______ ,为使反应持续进行,须适时向甲池中添加 ______ .
电化学降解法可用于治理水中硝酸盐的污染,所得产物可直接排入大气.其原理如图2所示,其中B为电源的 ______ 极,乙池中电极反应式为 ______ ,为使反应持续进行,须适时向甲池中添加 ______ .
【答案】bc 酸性 ![]()
![]() 2:3 负
2:3 负 ![]()
![]()
【解析】
![]() 溶于水生成
溶于水生成![]() ,是化合反应,而
,是化合反应,而![]() 与水反应不是化合反应;
与水反应不是化合反应; ![]() 与水反应生成亚硫酸是化合反应;
与水反应生成亚硫酸是化合反应;![]() 与水反应生成氢氧化钙是化合反应;
与水反应生成氢氧化钙是化合反应; ![]() 与水反应生成氢氧化钠和氧气不是化合反应;
与水反应生成氢氧化钠和氧气不是化合反应; ![]() 与水反应生成氢氟酸和氧气非化合反应;
与水反应生成氢氟酸和氧气非化合反应;
![]() 因为
因为![]() ,所以二步电离程度非常大,所以电离为主溶液呈酸性;
,所以二步电离程度非常大,所以电离为主溶液呈酸性;
![]() 氨水少量,据此书写离子方程式;
氨水少量,据此书写离子方程式;
![]() 已知
已知![]() ,
,![]() 大于
大于![]() 的一级电离常数分别为
的一级电离常数分别为![]() ,所以
,所以![]() 和
和![]() 两溶液混合,强酸制弱酸;
两溶液混合,强酸制弱酸;
![]() 在反应釜中反应物有
在反应釜中反应物有![]() 、
、![]() 、
、![]() ,生成物有
,生成物有![]() ,根据氧化还原反应得失电子相等和质量守恒定律书写离子方程,然后得出氧化剂与还原剂的物质的量之比;
,根据氧化还原反应得失电子相等和质量守恒定律书写离子方程,然后得出氧化剂与还原剂的物质的量之比;
![]() 硝酸根离子由
硝酸根离子由![]() 价变成0价得电子,发生还原反应,作为阴极,所以直流电源B为负极,阴极的电极反应式为:
价变成0价得电子,发生还原反应,作为阴极,所以直流电源B为负极,阴极的电极反应式为:![]() ,甲池是水电离出的氢氧根离子在阳极发生氧化反应,而氢离子转移到乙池中,即随放电的进行水的量在减少。
,甲池是水电离出的氢氧根离子在阳极发生氧化反应,而氢离子转移到乙池中,即随放电的进行水的量在减少。
![]() 溶于水生成
溶于水生成![]() ,反应方程式为
,反应方程式为![]() ,是化合反应,而
,是化合反应,而![]() 与水反应不是化合反应,故不选;
与水反应不是化合反应,故不选; ![]() 与水反应生成亚硫酸是化合反应,故选;
与水反应生成亚硫酸是化合反应,故选;![]() 与水反应生成氢氧化钙是化合反应,故选;
与水反应生成氢氧化钙是化合反应,故选; ![]() 与水反应生成氢氧化钠和氧气不是化合反应,故不选;
与水反应生成氢氧化钠和氧气不是化合反应,故不选; ![]() 与水反应生成氢氟酸和氧气非化合反应,故不选;故选:b c;
与水反应生成氢氟酸和氧气非化合反应,故不选;故选:b c;
![]() 因为
因为![]() ,所以二步电离程度非常大,所以电离溶液呈酸性,故答案为:酸性;
,所以二步电离程度非常大,所以电离溶液呈酸性,故答案为:酸性;
![]() 氨水少量所以第一步完全电离产生的氢离子,还过量,所以反应的离子方程式为:
氨水少量所以第一步完全电离产生的氢离子,还过量,所以反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 已知
已知![]() ,
,![]() 大于
大于![]() 的一级电离常数分别为
的一级电离常数分别为![]() ,所以
,所以![]() 和
和![]() 两溶液混合,强酸制弱酸,所以反应方程式为:
两溶液混合,强酸制弱酸,所以反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 在反应釜中反应物有
在反应釜中反应物有![]() 、
、![]() 、
、![]() ,生成物有
,生成物有![]() ,
,![]() 被还原为
被还原为![]() 价的Se,与
价的Se,与![]() 生成ZnSe,根据氧化还原反应得失电子相等和质量守恒定律,离子方程式为
生成ZnSe,根据氧化还原反应得失电子相等和质量守恒定律,离子方程式为![]() ,所以氧化剂
,所以氧化剂![]() 和还原剂
和还原剂![]() 的物质的量之比为2:3,故答案为:2:3;
的物质的量之比为2:3,故答案为:2:3;
![]() 硝酸根离子由
硝酸根离子由![]() 价变成0价得电子,发生还原反应,作为阴极,所以直流电源B为负极,阴极的电极反应式为:
价变成0价得电子,发生还原反应,作为阴极,所以直流电源B为负极,阴极的电极反应式为:![]() ,甲池是水电离出的氢氧根离子在阳极发生氧化反应,而氢离子转移到乙池中,所以要在甲池中加
,甲池是水电离出的氢氧根离子在阳极发生氧化反应,而氢离子转移到乙池中,所以要在甲池中加![]() ,故答案为:负;
,故答案为:负;![]() ;
;![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。