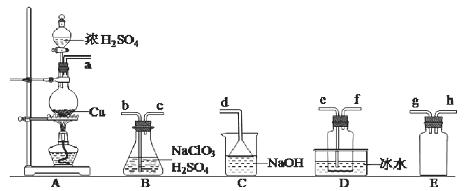
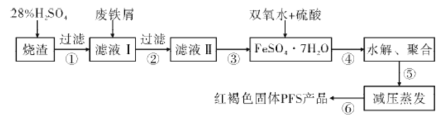
题目内容
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石![]() 含有少量
含有少量![]() 、
、![]() 杂质
杂质![]() 为原料制备沉淀碳酸钙的工艺流程如下:
为原料制备沉淀碳酸钙的工艺流程如下:
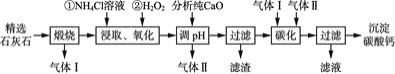
![]() 流程中可以循环利用的物质有气体 Ⅰ、气体Ⅱ和____
流程中可以循环利用的物质有气体 Ⅰ、气体Ⅱ和____![]() 填化学式
填化学式![]() 。
。
![]() “碳化”时发生反应的离子方程式为 ______________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________。
“碳化”时发生反应的离子方程式为 ______________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________。
![]() 工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:
工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:
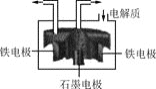
![]() 电解过程中,加入氯化钙的目的是________。
电解过程中,加入氯化钙的目的是________。
![]() 石墨电极发生的电极反应为________。
石墨电极发生的电极反应为________。
【答案】![]()
![]() 先通入气体Ⅱ
先通入气体Ⅱ![]() 或后通气体Ⅰ
或后通气体Ⅰ![]() 降低电解质的熔融温度,降低能耗
降低电解质的熔融温度,降低能耗 ![]()
【解析】
依据流程图可知,气体Ⅰ是二氧化碳,气体Ⅱ是氨气,产生的滤液是氯化铵。
精选石灰石中含有少量MgCO3、FeCO3杂质,经过煅烧,可生成二氧化碳气体,生成的固体加入氯化铵溶液、过氧化氢,可溶解并氧化FeO生成铁离子,加入分析纯CaO
生成气体为氨气,同时生成氢氧化镁、氢氧化铁沉淀,滤液中含有氯化钙,通入氨气、二氧化碳气体,可生成碳酸钙和氯化铵,以此解答该题。
![]() 根据分析可知流程中可以循环利用的物质有气体Ⅰ是二氧化碳,气体Ⅱ是氨气、和
根据分析可知流程中可以循环利用的物质有气体Ⅰ是二氧化碳,气体Ⅱ是氨气、和![]() ;故答案为:
;故答案为:![]() ;
;
![]() “碳化”时发生反应的离子方程式为:
“碳化”时发生反应的离子方程式为:![]() ,依据气体的性质
,依据气体的性质![]() 氨气易溶于水,加入后可以提高二氧化碳的溶解度
氨气易溶于水,加入后可以提高二氧化碳的溶解度![]() ,所以该过程中通入气体Ⅰ和气体Ⅱ的顺序是先通入气体Ⅱ
,所以该过程中通入气体Ⅰ和气体Ⅱ的顺序是先通入气体Ⅱ![]() 或后通气体Ⅰ
或后通气体Ⅰ![]() 。故答案为:
。故答案为:![]() ;先通入氨气
;先通入氨气![]() 或后通气体Ⅰ
或后通气体Ⅰ![]() ;
;
![]() 电解过程中,加入氯化钙的目的是:降低电解质的熔融温度,降低能耗。故答案为:降低电解质的熔融温度,降低能耗;
电解过程中,加入氯化钙的目的是:降低电解质的熔融温度,降低能耗。故答案为:降低电解质的熔融温度,降低能耗;
![]() 铁电极若为阳极会参与反应,所以石墨电极为阳极,发生的电极反应方程式为:
铁电极若为阳极会参与反应,所以石墨电极为阳极,发生的电极反应方程式为:![]() 。故答案为:
。故答案为:![]() 。
。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如图1:
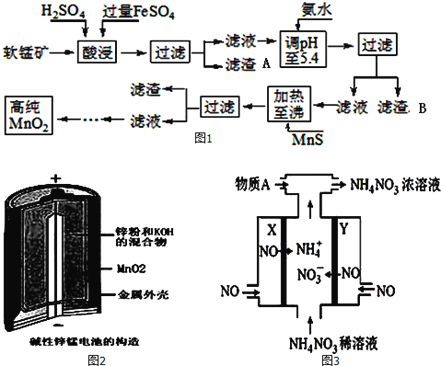
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________;
(2)滤渣A的主要成分是____________;滤渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+杂质,可能原因是_________________;
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为________________,电池总反应的方程式为_______________________;
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极__________极,电解时阳极的电极反应为________________,使电解产物全部转化为NH4NO3,需补充物质A,A是__________;