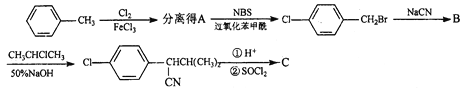
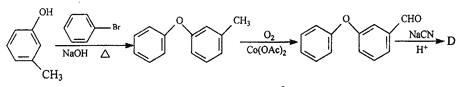
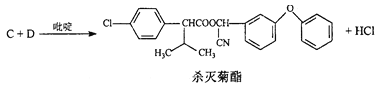
题目内容
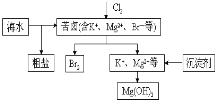
【题目】高锰酸钾是中学化学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下:
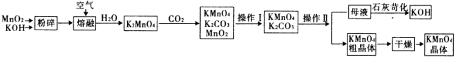
(1)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+),Mn2+的氧化产物为MnO4-,写出反应的离子方程式_________________________________________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有氢氧化钾和_______(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1 mol MnO2可制得_____mol KMnO4。
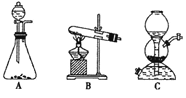
(5)该生产中需要纯净的CO2气体。写出实验室制取CO2的化学方程式___________________,所需气体发生装置可以是______(选填代号)。
(6)操作Ⅰ的名称是________;操作Ⅱ根据 KMnO4和K2CO3两物质在______(填性质)上的差异,
采用__________(填操作步骤)、趁热过滤得到 KMnO4。
【答案】
(1)2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O
(2)ab
(3)MnO2
(4)![]() mol
mol
(5)CaCO3+2HCl═CaCl2+H2O+CO2↑, AC
(6)过滤,溶解性,浓缩结晶
【解析】
试题分析:二氧化锰与氢氧化钾在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,滤液中含有K2CO3,在滤液中加氢氧化钙得到碳酸钙沉淀和KOH;
(1)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,则反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
(2)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,答案为ab;
(3)根据流程分析可知:在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用;
(4)由2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到
2K2MnO4+2H2O 可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到![]() molKMnO4;
molKMnO4;
(5)实验室用盐酸与石灰石制备二氧化碳,其反应的方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,反应不需要加热,可以用启普发生器制备,所以选用的装置为A或C;
(6)该操作是分离固体与溶液,是过滤操作,KMnO4和K2CO3在溶解性上不同采用热的情况下采用浓缩结晶的方式可分离。

【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(1)设计该实验方案的目的是:探究同周期元素的__________________________。
(2)实验①的现象是 ,反应的化学方程式是 。
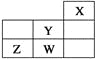
【实验二】 为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图。
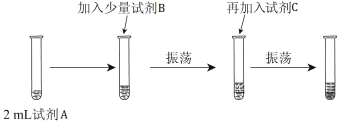
(3)试剂A是 ;试剂B是 ;试剂C是 。
(4)试剂C在实验中所起的作用是 ,加入C振荡、静置后看到的现象是: 。以上反应可以证明Cl2的非金属性_______(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:_______________。
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程: 。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g)△H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10-16,K稳Ag(CN)2-]=1.0×1021,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
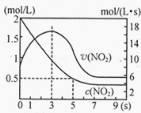
①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。