题目内容
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程: 。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g)△H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10-16,K稳Ag(CN)2-]=1.0×1021,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
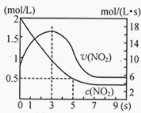
①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
【答案】(1)![]() (1分)
(1分)
(2)N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=-631.7kJ/mol (2分)
(3)AgI(s)+2CN—(aq)![]() Ag(CN)2—(aq)+I—(aq)(2分) 1.5×105(2分)
Ag(CN)2—(aq)+I—(aq)(2分) 1.5×105(2分)
(4)NH3—5e—+5OH—=NO+4H2O(2分)
(5)容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大(1分); 75%
【解析】
试题分析:(1)氮气是含有氮氮三键的单质,用电子式表示氮气的形成过程为![]() ;
;
(2)△H等于反应物的键能之和-生成物的键能之和,N2H4 (g)燃烧热的热化学方程式为N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=(390.8×4+193+497.3)-(946+462.8×4)-44×2=—631.7kJ/mol;
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为AgI(s)+2CN-(aq)![]() Ag(CN)2-(aq)+I-(aq);则上述转化方程式的平衡常数K=
Ag(CN)2-(aq)+I-(aq);则上述转化方程式的平衡常数K=![]() =
= =
=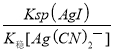 =1.5×105;
=1.5×105;
(4)氨的催化氧化的方程式为4NH3+5O2═4NO+6H2O,该反应设计成新型电池,在碱性环境下,该电池的负极上氨气失去电子生成一氧化氮气体,电极反应式为NH3—5e-+5OH-=NO+4H2O;
(5)①依据反应是放热反应,在绝热恒容容器中,反应放热,温度升高,反应速率增大,随反应进行二氧化氮浓度减小,反应未达到平衡,0~3s时v(NO2)增大是由于体系温度升高。
②分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,因此5s时NO2转化率为=![]() ×100%=75%。
×100%=75%。