��Ŀ����
����Ŀ���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO(g)+2H2 (g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
![]()
�ɱ��������жϦ�H________0 (�����������������)����ѧƽ�ⳣ������ʽK=________��
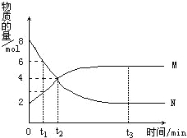
��2��300��ʱ�������Ϊ2.0 L���ܱ�������ͨ��2 mol CO��4 mol H2������20 s�ﵽƽ��״̬��
������20 s��CO�ķ�Ӧ����Ϊ________����ʱ�����м״����������Ϊ_________��
����������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬ƽ���ƶ������__________(����ҡ����������ƶ���)��ԭ����________________________
��3����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2 (g) = 2CO2 (g)��4H2O(g) ��H����1277.0kJ/mol
��2CO(g)+O2 (g) = 2CO2(g) ��H����566.0kJ/mol
��H2O(g) =H2O(l) ��H����44kJ/molд���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
__________________��
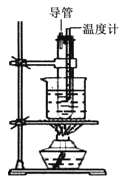
��4���״�������������ȼ�ϵ�أ�д������������Ϊ����ʼ״�ȼ�ϵ�ظ�����Ӧʽ_______________����ͼ�����KI��Һ�Ƶ⣬�ڴ��Թ��м��뱥�͵�KI��Һ��Ȼ���ټ��뱽������һ��ʯī�缫��һ�����缫��ʹ�ø�ȼ�ϵ������Դ�����缫�뼫___________�������������ӣ�ͨ��һ��ʱ��Ͽ���Դ�����Թܣ��ϲ���ҺΪ_______ɫ������ 1.27g�ⵥ������ʱ,��Ҫ_______g CH3OH��

���𰸡�
��1���� �� ![]()
��2����0.025mol/(L��s) 25% �� ����������ʱŨ����Qc=![]() =0.25
=0.25
��3��-443.5kJmol-1
��4��CH3OH-6e-+8OH-=CO32-+6H2O�������Ϻ��� 0.053
��������
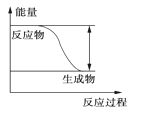
�����������1�����ݱ����¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵������ƽ�����淴Ӧ�����ƶ������Ը÷�Ӧ�Ƿ��ȷ�Ӧ������H1��0����ѧƽ�ⳣ���ı���ʽK=![]() ��
��
��2���� CO(g)+2H2 (g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��ʼŨ�ȣ�mol/L�� 1 2 0
�仯Ũ�ȣ�mol/L�� c 2c c
ƽ��Ũ�ȣ�mol/L�� 1-c 2-2c c
��ʱƽ�ⳣ��K=1=![]() ����ã�c=0.5mol/L��20 s��CO�ķ�Ӧ����Ϊ
����ã�c=0.5mol/L��20 s��CO�ķ�Ӧ����Ϊ![]() =
=![]() =0.025mol/(L��s)����ʱ�����м״����������Ϊ
=0.025mol/(L��s)����ʱ�����м״����������Ϊ![]() ��100%=25%��
��100%=25%��
����������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬��ʱQc=![]() =0.25��K����ʱƽ�������ƶ���
=0.25��K����ʱƽ�������ƶ���
��3�����ݸ�˹���ɣ�����֪��Ӧ����-��+����4����2�õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Ը÷�Ӧ����H=![]() [��-1277.0kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]=-443.5kJmol-1��
[��-1277.0kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]=-443.5kJmol-1��
��4������������Ϊ����ʼ״�ȼ�ϵ�ظ�����ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��I-����������ΪI2����Fe������������ֻ�������������Դ����������ͨ��һ��ʱ������ɵĵⵥ���ܽ��ڱ��У������ܶȱ�ˮС�����ϲ㣬Ϊ�ܽ����Ϻ�ɫ��Һ������1.27g�ⵥ������ʱ��ת�Ƶ���Ϊ0.01mol����Ҫ��CH3OH����Ϊ![]() ��32g/mol=0.053g��
��32g/mol=0.053g��

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�