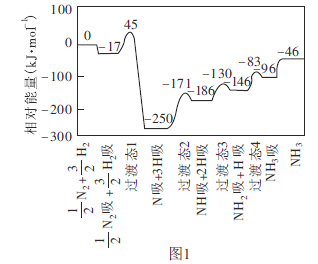
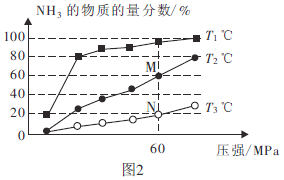
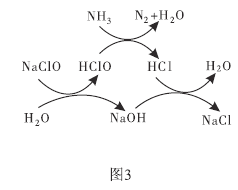
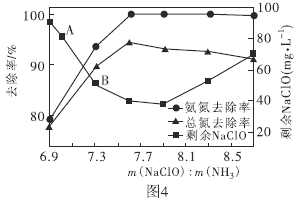
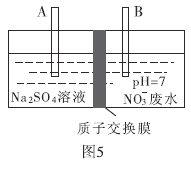
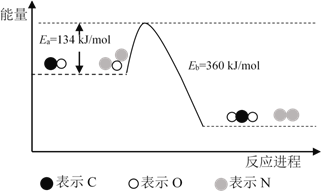
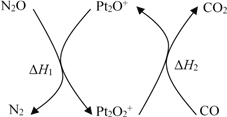
题目内容
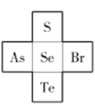
【题目】标号为①~⑩的元素,在元素周期表中的位置如图:
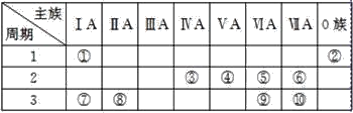
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是___(填写元素符号)。
(2)①和④号元素形成的化合物的化学式为___,用电子式表示其形成过程为___。
(3)⑧号元素的最高价氧化物的水化物的化学式是___。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是__,在该化合物中既含有___键,又含有____键。
【答案】H、F、Cl NH3 ![]() Mg(OH)2 Na+[
Mg(OH)2 Na+[![]()
![]()
![]() H]- 离子 极性共价
H]- 离子 极性共价
【解析】
由元素在周期表中位置,可知①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl。
(1)其原子只要形成一对共用电子对就达到了稳定结构是H、F、Cl;
(2)①和④号元素形成的化合物为NH3,属于共价化合物,用N原子、H原子电子式表示其形成过程;
(3)⑧号元素的最高价氧化物的水化物为氢氧化镁;
(4)①、⑤、⑦号元素形成的一种化合物为NaOH,由钠离子与氢氧根离子构成,该化合物中含有离子键、共价键。
原子只要形成一对共用电子对就达到了稳定结构,说明该原子最外层可能只含1个电子或者含7个电子。①号元素是氢;④号元素是氮;⑤号元素是氧;⑦号元素是钠;⑧号元素为镁。
(1)其原子只要形成一对共用电子对就达到了稳定结构是H、F、Cl;故答案为:H、F、Cl;
(2)①和④号元素形成的化合物为NH3,属于共价化合物,用N原子、H原子电子式表示其形成过程![]() ;故答案为:NH3;
;故答案为:NH3;![]() ;
;
(3)⑧号元素的最高价氧化物的水化物为氢氧化镁;故答案为:Mg(OH)2;
(4)①、⑤、⑦号元素形成的一种化合物的电子式是Na+[![]()
![]()
![]() H]-;在该化合物中既含有离子键,又含有极性共价键,故答案为:Na+[
H]-;在该化合物中既含有离子键,又含有极性共价键,故答案为:Na+[![]()
![]()
![]() H]-;离子;极性共价。
H]-;离子;极性共价。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案