题目内容
【题目】中科院上海硅酸盐研究所开发出基于硫化银(![]() )柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的
)柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的![]() 薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
(1)Ag的核外电子排布式是![]() ,则Ag在元素周期表中的位置是____。下列关于
,则Ag在元素周期表中的位置是____。下列关于![]() 的电子排布式书写正确的是____(填标号)。
的电子排布式书写正确的是____(填标号)。
a.![]() b.
b.![]() c.
c.![]()
(2)乙硫醇(![]() )是一种含硫有机物,和醋酸银可发生下列反应:
)是一种含硫有机物,和醋酸银可发生下列反应:![]()
乙硫醇中S原子的杂化类型是______。乙酸中羧基碳原子的杂化类型是_____,乙酸中含有的![]() 键数:
键数:![]() 键数=_____。
键数=_____。
(3)Cu与Ag为同族元素,熔点:Cu________Ag(填“>”或“<”),原因是________________。
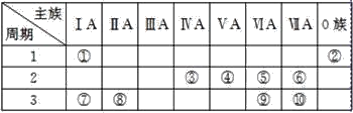
(4)S、Se、Te在元素周期表中与其他元素的位置关系如下图所示,则Te、As、Se、Br的第一电离能由大到小的顺序为________,![]() 的空间构型为________。
的空间构型为________。
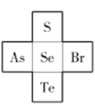
(5)ZnS的晶胞结构如下图所示,其密度为![]() ,晶胞边长
,晶胞边长![]() ________pm(用含
________pm(用含![]() 、
、![]() 的代数式表示,
的代数式表示,![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
【答案】第五周期IB族 b ![]()
![]() 7:1 > 铜和银的价电子数相同,Cu的原子半径比Ag的小,前者金属键强,熔点高
7:1 > 铜和银的价电子数相同,Cu的原子半径比Ag的小,前者金属键强,熔点高 ![]() 三角锥形
三角锥形 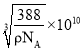
【解析】
根据原子的电子层数及其价电子数确定元素在周期表中的位置;根据原子及离子的电子排布式分析;根据价层电子对数目和价层电子互斥理论分析原子的杂化类型和空间构型;根据晶胞结构分析晶体的化学式并进行相关计算。
(1)Ag的核外电子排布式是![]() ,最高能层数是5,属ds区元素,则Ag在元素周期表中的位置是第五周期IB族;Ag原子失去5s1上的1个电子得到Ag+,则Ag+电子排布式书为
,最高能层数是5,属ds区元素,则Ag在元素周期表中的位置是第五周期IB族;Ag原子失去5s1上的1个电子得到Ag+,则Ag+电子排布式书为![]() ,故答案为b;
,故答案为b;
(2)乙硫醇(CH3CH2SH)中S原子的价层电子对数目为4,其中孤对电子数2,杂化类型是sp3杂化;羧基中碳原子的价层电子对数为3,无孤对电子,杂化类型是sp2杂化;乙酸的结构式为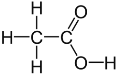 ,其中单键均为σ键,双键中有1个σ键和1个π键,则含有的σ键数:π键数=7:1;
,其中单键均为σ键,双键中有1个σ键和1个π键,则含有的σ键数:π键数=7:1;
(3)Cu与Ag为同族元素,铜和银的价电子数相同,且Ag的核电荷数大,Cu的原子半径比Ag的小,Cu金属键强,Cu熔点高,即熔点:Cu>Ag;
(4) As、Se、Br同周期随原子序数增大第一电离能呈增大趋势,但As元素原子4p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,Se、Te同主族,自上而下第一电离能减小,故第一电离能:Br>As>Se>Te;SeO32-中Se的价层电子对数目为3+![]() =4,其中孤对电子数目为1,VSEPR模型为四面体,忽略孤对电子可得微粒空间构型为三角锥形;
=4,其中孤对电子数目为1,VSEPR模型为四面体,忽略孤对电子可得微粒空间构型为三角锥形;
(5)ZnS的晶胞结构中含有Zn2+数目4,S2-数目为8×![]() +6×
+6×![]() =4,则晶胞质量为
=4,则晶胞质量为![]() g,晶胞的体积为(acm) 3,根据
g,晶胞的体积为(acm) 3,根据![]() 可知,a=
可知,a=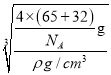 =
=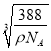 cm=
cm=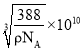 pm。
pm。