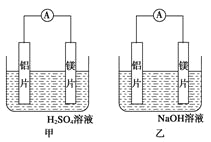
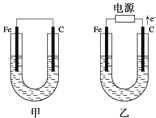
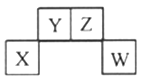
题目内容
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
【答案】0.16 0.03 0.05 6.96
【解析】
根据氯气的尾气吸收的化学方程式8Cl2+16NaOH=5NaClO+NaClO3+10NaCl+8H2O和实验室制氯气的化学方程式MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O进行计算。
MnCl2+Cl2↑+2H2O进行计算。
⑴反应前NaOH的物质的量为:0.1 L×1.7 mol/L = 0.17 mol
反应后NaOH的物质的量为:0.1 L×0.1 mol/L = 0.01 mol
消耗的NaOH物质的量为:0.16 mol
⑵根据ClO-和ClO3-的物质的量浓度之比为5∶1可写出反应方程式:8Cl2+16NaOH=5NaClO+NaClO3+10NaCl+8H2O,
则反应掉的氯气n(Cl2)=![]() n(NaOH)=
n(NaOH)=![]() ×0.16mol=0.08mol,
×0.16mol=0.08mol,
其中被氧化的氯气即化合价升高的为![]() ,即为
,即为![]() ×0.08mol=0.03mol,
×0.08mol=0.03mol,
则被还原的氯气即为0.08-0.03=0.05mol;
⑶ 由(2)可知,尾气中的氯气为0.08mol,根据化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知,消耗二氧化锰的物质的量和氯气的物质的量相等,即n(MnO2)=0.08mol,所以m(MnO2) =87g×0.08mol/1mol=6.96 g。
MnCl2+Cl2↑+2H2O可知,消耗二氧化锰的物质的量和氯气的物质的量相等,即n(MnO2)=0.08mol,所以m(MnO2) =87g×0.08mol/1mol=6.96 g。

【题目】某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
离子 |
|
|
|
|
|
|
|
含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
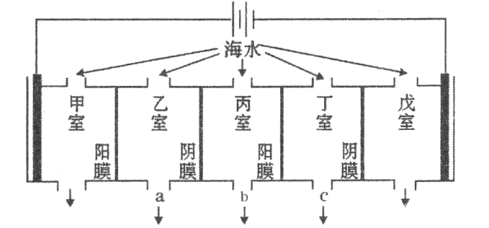
A.甲室的电极反应式为:![]()
B.乙室和丁室中部分离子的浓度增大,淡水的出口为b
C.当戊室收集到![]() (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为
(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为![]()
D.淡化过程中易在戊室形成水垢