题目内容
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)![]() 2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是______%(保留整数)。
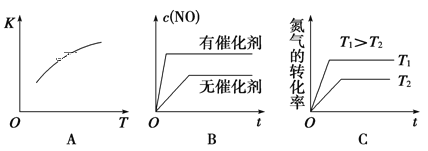
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应__________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 _______。将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 ________(填字母序号)。
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______(填“变大、“变小”或“不变)
【答案】4 向正反应方向进行 Qc=9×10﹣4<K AC 不变
【解析】
(1)根据反应方程式,利用三段式法结合平衡常数计算转化率;
(2)计算某时刻生成物的浓度幂之积与反应物浓度幂之积的比值,与该温度下的平衡常数相比较,可得出结论,根据温度、催化剂对反应速率和平衡移动的影响判断;
(3)根据化学方程式的特点结合压强对平衡的影响分析。
(1)设平衡时氮气的转化的物质的量为x,则根据反应方程式N2(g)+O2(g)![]() 2NO(g)可知,反应会消耗O2的物质的量是x mol,同时产生2x mol NO,则平衡时各种气体的物质的量n(N2)=n(O2)=(1-x)mol,n(NO)=2x mol,由于该反应是反应前后等体积的反应,所以化学平衡常数中可以用相应的物质的量代替物质的量浓度,可得
2NO(g)可知,反应会消耗O2的物质的量是x mol,同时产生2x mol NO,则平衡时各种气体的物质的量n(N2)=n(O2)=(1-x)mol,n(NO)=2x mol,由于该反应是反应前后等体积的反应,所以化学平衡常数中可以用相应的物质的量代替物质的量浓度,可得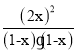 =64×10-4,解得x=0.04mol,所以平衡时N2的转化率为
=64×10-4,解得x=0.04mol,所以平衡时N2的转化率为![]() × 100%=4%;
× 100%=4%;
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为: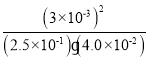 =9×10-4<K,说明反应未达到化学平衡,反应向正反应方向进行;
=9×10-4<K,说明反应未达到化学平衡,反应向正反应方向进行;
A.该反应的正反应为吸热反应,升高温度,化学平衡向正反应进行,平衡常数增大,A正确;
B.加入催化剂,反应速率增大,但由于正、你反应速率增大的倍数相同,所以化学平衡不发生移动,B错误;
C.升高温度,反应速率增大,达到平衡所需要的时间缩短,且升高温度,化学平衡向吸热的正反应方向移动,使氮气的平衡转化率增大,C正确;
故合理选项是AC;
(3)由于该反应是反应前后气体体积不变的反应,所以增大压强对平衡移动没有影响。只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时的平衡混合气中NO的体积分数不变。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案