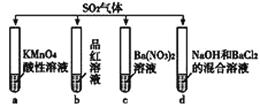
题目内容
【题目】碱式碳酸镁和碱式碳酸铝镁均可作为塑料填料。由蛇纹石制取碱式碳酸镁的实验步骤如下:
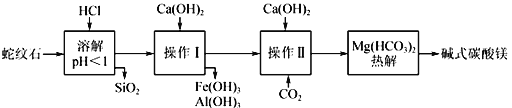
(蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成)
(1)上述实验中,可以循环使用的物质是______(填化学式)。
(2)操作Ⅰ中的Ca(OH)2要适量,其原因是____________________________。
(3)写出操作Ⅱ中生成Mg(HCO3)2的化学方程式:____________________________________。
(4)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取5.085 g样品与足量稀盐酸充分反应,生成CO2 0.840 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图所示(样品在270℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
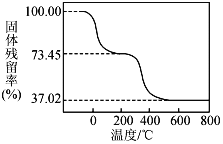
根据以上实验数据计算5.085 g碱式碳酸铝镁样品中的n(OH-)(写出计算过程)_______。
【答案】 CO2 使Fe3+、Al3+全部沉淀而Mg2+不生成沉淀 MgCl2+2CO2+Ca(OH)2=Mg(HCO3)2+CaCl2 0.0225mol
【解析】蛇纹石加盐酸溶解,MgO、Fe2O3、Al2O3和盐酸反应溶解,而SiO2不与盐酸反应,以沉淀的形式除去,所得溶液中含有金属阳离子,加入氢氧化钙得到氢氧化铁、氢氧化铝沉淀,过滤得到的滤液中含有镁离子,加入氢氧化钙同时通入二氧化碳生成碳酸氢镁,碳酸氢镁热分解得到碱式碳酸镁;
(1)碳酸氢镁热分解时会产生二氧化碳,可以循环使用的物质是CO2。(2)由于要使Fe3+、Al3+全部沉淀而Mg2+不生成沉淀,所以操作Ⅰ中的Ca(OH)2要适量。(3)操作Ⅱ中生成Mg(HCO3)2的化学方程式为MgCl2+2CO2+Ca(OH)2=Mg(HCO3)2+CaCl2。(4)m(CO2)=![]() =1.65g,根据图像可知完全失去结晶水后继续加热分解生成的二氧化碳和水的质量为m(CO2)+m(H2O)=5.085g×(0.7345-0.3702)=1.8525g,所以m(H2O)=0.2025g,则n(OH-)=
=1.65g,根据图像可知完全失去结晶水后继续加热分解生成的二氧化碳和水的质量为m(CO2)+m(H2O)=5.085g×(0.7345-0.3702)=1.8525g,所以m(H2O)=0.2025g,则n(OH-)=![]() =0.0225mol。
=0.0225mol。

【题目】SO2是国内外允许使用的一种食品添加剂,在食品工业中发挥着护色、防腐、漂白和抗氧化的作用。我国对于SO2的添加量有明确规定(如图所示)。

某研究小组用图装置对市售黄花菜中的SO2进行测定。其中,溶液X为黄花菜进行充分浸泡后所得浅黄色浸泡液,Y为加入的试剂。(Y的浓度及体积均未标出)查阅资料发现,在水溶液中正四价硫元素主要以SO32-形式存在,且SO2与SO32-化学性质相似。因此,该小组同学将SO2的测定问题转化为溶液中SO32-的测定。
(1)结合化学知识解释浸泡液X中存在SO32-的原因是______。
(2)甲同学预测可用Na2S溶液验证X中是否含有SO32-,该预测应用的是Na2S的______性。查阅资料发现该反应较为复杂,因此未做进一步验证。
(3)乙同学为验证X中是否含有SO32-,进行了实验i:
实验序号 | 试剂Y | 现象 |
i | 酸性KMnO4溶液 | ① |
根据实验i 的现象得出结论:X中含有SO32-。实验i的现象是________,SO32-在反应后转化为_________。
(4)丙同学认为也可以用H2O2溶液来验证X中是否含有SO32-,进行了实验ii:
实验序号 | 操作 | 现象 |
ii | a.向X中加入适量H2O2溶液,振荡 | 无明显现象 |
b.继续滴加 ,振荡 | 无明显现象 | |
c.再滴加 ,振荡 | 白色沉淀 |
通过实验ii可证明X中含有SO32-,写出操作b、c中滴加试剂的化学式____、 _____ 。
(5)丁同学认为丙的实验方案不严谨,设计了对比实验ⅲ,证明了X中含有SO32-。实验ⅲ的方案是(从操作、现象、结论方面描述)________ 。
(6)为测定市售黄花菜中SO2含量,进行实验ⅳ:
实验序号 | 操作 |
ⅳ | a.将50克黄花菜研碎,用一定浓度氢氧化钠溶液浸泡; b.加稀硫酸酸化; c.加入淀粉指示剂; d.用浓度为0.01mol/L的I2溶液滴定,消耗0.01mol/L的I2溶液5.00 mL。 |
查阅资料发现:碘元素的常见价态有-1,0,+1,+3,+5,+7。
① 将黄花菜用氢氧化钠溶液浸泡的目的是(用化学方程式表示)__________。
② 写出滴定反应的化学方程式____________。
③ 该市售黄花菜中SO2残留量是________毫克/千克。