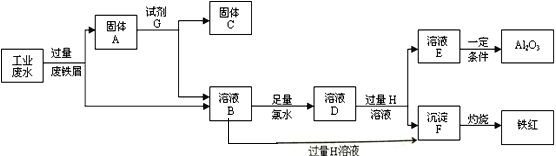
题目内容
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是
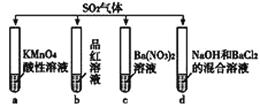
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,该沉淀的成分为BaSO3
D. 试管d中能产生白色沉淀,该沉淀完全溶于稀盐酸
【答案】D
【解析】A. 酸性高锰酸钾溶液具有强氧化性,试管a中实验可以证明SO2具有还原性,A错误;B. 试管b中品红溶液褪色,说明SO2具有漂白性,B错误;C. 二氧化硫溶于水显酸性,硝酸根把二氧化硫氧化为硫酸根,所以试管c中能产生白色沉淀,该沉淀的成分为BaSO4,C错误;D. 二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与氯化钡反应生成亚硫酸钡沉淀,所以试管d中能产生白色沉淀,亚硫酸钡能完全溶于稀盐酸,D正确,答案选D。

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目