题目内容
2.由下列结构片段组成的蛋白质在胃液中水解,不可能产生的氨基酸是( )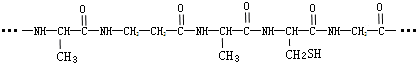
| A. | 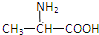 | B. | H2NCH2COOH | C. | 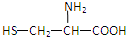 | D. | 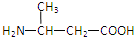 |
分析 蛋白质是复杂的多肽,水解生成氨基酸,氨基酸形成多肽时是氨基脱氢,羧基脱去羟基,所以蛋白质水解,分子结构中含有的 断碳氧双键和碳氮单键,水解得到羧基和氨基,生成相应的氨基酸,据此即可解答.
断碳氧双键和碳氮单键,水解得到羧基和氨基,生成相应的氨基酸,据此即可解答.
解答 解:两个氨基酸分子,在酸或碱的存在下加热,通过一分子的氨基和另一分子的羧基间脱去一分子水缩合形成含有肽键的化合物,称为成肽反应,蛋白质水解断裂的是肽键,断碳氧双键和碳氮单键之间,生成相应的氨基酸,故该化合物生成的氨基酸的结构简式为: (A选项符合);NH2CH2CH2COOH;
(A选项符合);NH2CH2CH2COOH; (C选项符合).
(C选项符合).
故选BD.
点评 本题主要考查了蛋白质的结构和性质特点,把握氨基酸在形成多肽时的变化规律是解题的关键,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
12. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:T<X | B. | R与Q的电子数相差16 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:T>Q |
13.下列各组物质中化学键的类型相同的是( )
| A. | HCl、NH4Cl | B. | Na2O、CO2 | C. | CaCl2、NaOH | D. | NH3、H2O |
10.几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R的单质与稀盐酸反应速率L<R | |
| B. | M与R性质相似 | |
| C. | Q、T两元素的氢化物沸点:T的氢化物低于Q的氢化物 | |
| D. | L、M、Q形成的简单离子半径由大到小顺序是L>M>Q |
17.接触法生产硫酸的过程中,对废气、废水、废渣、废热的处理正确的是( )
①尾气用氨水处理
②污水用石灰乳处理
③废渣用来造水泥、炼铁
④设置废热锅炉产生蒸汽、供热或发电.
①尾气用氨水处理
②污水用石灰乳处理
③废渣用来造水泥、炼铁
④设置废热锅炉产生蒸汽、供热或发电.
| A. | ①②③④ | B. | ①③④ | C. | ①②③ | D. | ①② |
7.下列叙述中,正确的是( )
| A. | 1 mol 乙烯分子中含有的σ 键数目为5NA | |
| B. | 1 mol甲基(-CH3)中含有电子的数目为10NA | |
| C. | 标准状况下,1L戊烷在空气中完全燃烧生成$\frac{5}{22.4}$L的CO2 | |
| D. | 14 g乙烯和丙烯的混合物中含有的氢原子总数为3NA |
14. A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
回答下列问题:
(1)基态E原子的核外M层电子云有9种不同的伸展方向,基态E原子核外价电子排布式为3d54s1,元素F属于d区.
(2)A与C形成的最简单分子的空间构型为三角锥形,中心原子的杂化方式为sp3.
(3)B,C,D第一电离能由大到小的顺序是N>O>C(用元素符号表示);由B,C,D中的两种元素组成的常见分子互为等电子体的是N2O和CO2
(4)E元素可以形成配位 数为6的两种配合物,它们的化学式都是ECl3﹒6H2O,其中一种呈亮棕色,与硝酸银溶液反应时,能沉淀出$\frac{1}{3}$的氯元素,该配合物可表示为[Cr(H2O)4Cl2]Cl•2H2O.
(5)元素F的一种氯化物的晶胞结构如图 所示(黑球表示F原子,白球表示氯原子),每个氯原子周围与之距离最近的氯原子个数为12;若晶胞的密度为4.14g﹒cm-3,该晶胞的边长为$\root{3}{\frac{398}{4.14{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
 A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:| A | 宇宙中含量最丰富的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最高价氧化物对应的水化物与其氢化物反应生成盐 |
| D | 原子核外电子有8种不同的运动状态 |
| E | 基态原子核外有六个未成对电子 |
| F | 原子最外层只有一个电子 |
(1)基态E原子的核外M层电子云有9种不同的伸展方向,基态E原子核外价电子排布式为3d54s1,元素F属于d区.
(2)A与C形成的最简单分子的空间构型为三角锥形,中心原子的杂化方式为sp3.
(3)B,C,D第一电离能由大到小的顺序是N>O>C(用元素符号表示);由B,C,D中的两种元素组成的常见分子互为等电子体的是N2O和CO2
(4)E元素可以形成配位 数为6的两种配合物,它们的化学式都是ECl3﹒6H2O,其中一种呈亮棕色,与硝酸银溶液反应时,能沉淀出$\frac{1}{3}$的氯元素,该配合物可表示为[Cr(H2O)4Cl2]Cl•2H2O.
(5)元素F的一种氯化物的晶胞结构如图 所示(黑球表示F原子,白球表示氯原子),每个氯原子周围与之距离最近的氯原子个数为12;若晶胞的密度为4.14g﹒cm-3,该晶胞的边长为$\root{3}{\frac{398}{4.14{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
11.常温下,已知有某浓度的CH3COOH溶液,下列说法不正确的是( )
| A. | 该溶液与等浓度NaOH溶液等体积混合后,pH>7 | |
| B. | 测得Na2CO3的碱性比CH3COONa溶液强,因此得出醋酸的酸性比碳酸强的结论 | |
| C. | 若向该溶液中加入少量CH3COONa固体,恢复至常温后,c(CH3COOH)比原来增大 | |
| D. | 若向一定浓度的CH3COONa溶液中加入少量CH3COONa固体,恢复至常温后,其水解程度比原来下降 |
6.下列实验能达到实验目的且符合安全要求的是( )
| A. | 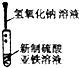 制备氢氧化亚铁 | B. | 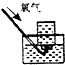 收集氧气 | ||
| C. |  制备并检验氢气的可燃性 | D. | 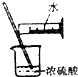 浓硫酸稀释 |