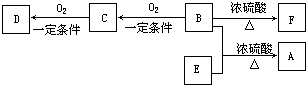
题目内容
13.下列各组物质中化学键的类型相同的是( )| A. | HCl、NH4Cl | B. | Na2O、CO2 | C. | CaCl2、NaOH | D. | NH3、H2O |
分析 一般来说,活泼金属和活泼非金属元素易形成离子键,非金属元素之间易形成共价键,以此来解答.
解答 解:A.HCl中氢原子和氧原子之间存在共价键,NH4Cl中氯离子和铵根离子之间存在离子键,故A不选;
B.Na2O中氧离子和钠离子之间存在离子键,CO2中只含C、O之间形成的共价键,故B不选;
C.CaCl2中只含离子键,NaOH中含离子键和O-H共价键,故C不选;
D.NH3、H2O中均只含极性共价键,化学键类型相同,故D选;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.部分弱酸的电离平衡常数如表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| C. | 等浓度的HCOONa和NaCN溶液的pH前者大于后者 | |
| D. | 中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者 |
4.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| C. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
1.某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几钟.将X通过适量的氯水时,X完全被吸收.将所得的无色溶液分装于两支试管后,分别加入酸化AgNO3与BaCl2溶液,结果均产生白色沉淀.下列推论正确的是( )
| A. | X中可能有HBr | B. | X中一定有SO2 | C. | X中可能有CO2 | D. | X中一定有HCl |
8.下列反应中,Q2>Q1的是( )
| A. | H2(g)+F2(g)=2HF(g)△H=-Q1 kJ•mol-1 H2(g)+Cl2(g)=2HCl(g)△H=-Q2 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1 kJ•mol-1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 kJ•mol-1 | |
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-Q1 kJ•mol-1 NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-Q2 kJ•mol-1 | |
| D. | S(s)+O2(g)=SO2(g)△H=-Q1 kJ•mol-1 S(g)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1 |
18.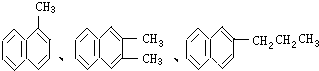 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )
 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-8(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
2.由下列结构片段组成的蛋白质在胃液中水解,不可能产生的氨基酸是( )
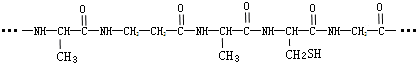

| A. | 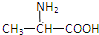 | B. | H2NCH2COOH | C. | 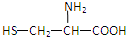 | D. | 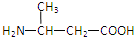 |
3.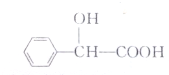 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )
 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )| A. | 该物质的分子式为C8H8O3 | |
| B. | 该物质分子中的8个碳原子都在同一个平面上 | |
| C. | 该物质既可以发生酯化反应又可以发生缩聚反应 | |
| D. | 1mol该物质可以与2mol金属Na反应 |